表明金属甲比金属乙活动性强的是( )
| A.在氧化还原反应中,甲失电子比乙的多 |
| B.同价态的阳离子,甲比乙氧化性强 |
| C.甲能与盐酸反应放出氢气而乙不能 |
| D.将甲乙组成原电池时,甲为正极 |
下列实验装置不能达到实验目的的是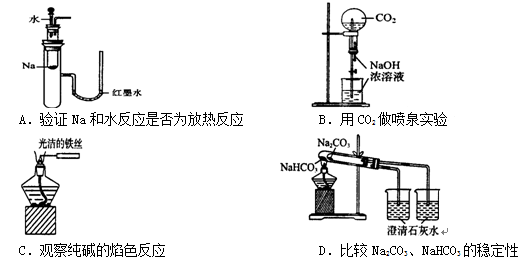
在“十二五”期间,山东省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
| A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 |
| B.加强城市生活污水脱氮除磷处理,遏制水体富营养化 |
| C.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
| D.加大稀土资源的开采和出口,保证经济快速发展 |
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol·L-1NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是
| A.从反应开始至②点,发生反应的离子方程式为:Cl2 +H2O ="=" ClO-+ 2H++ Cl- |
| B.③处表示氯气和NaOH溶液恰好完全反应 |
| C.②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- |
| D.从反应开始至②点可用pH试纸测定溶液的pH |
将0.4mol体积比为1∶1甲和乙两种混合气体同时通入50mL1mol·L-1的丙溶液中,无沉淀产生的是
| 序号 |
甲 |
乙 |
丙 |
| A |
Cl2 |
SO2 |
Ba(NO3) 2 |
| B |
HCl |
CO2 |
石灰水 |
| C |
NH3 |
SO2 |
Ba(OH)2 |
| D |
NO2 |
SO2 |
BaCl2 |
NaNO2是一种食品添加剂,它能致癌。酸性高锰酸钾溶液与亚硝酸钠的反应方程式是:MnO4-+ NO2-+ H+→Mn2+ + NO3-+ H2O。下列叙述中正确的是
| A.NaNO2既具有氧化性又具有还原性 |
| B.该反应中NO2-被还原 |
| C.反应过程中溶液的pH变小 |
| D.生成1molNaNO3需要消耗0.6molKMnO4 |