钢铁在空气中发生电化学腐蚀时,正极上发生的电极反应为( )
A.Fe —3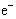 ="=" ="=" 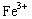 |
B.2H2O + O2 + 4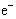 ==4OH- ==4OH- |
C.Fe —2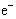 ="=" ="=" 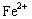 |
D.4OH-—4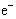 ==2H2O + O2↑ ==2H2O + O2↑ |
下列说法正确的是:()
| A.需要加热才能发生的反应一定是吸热反应 |
| B.在甲烷燃烧反应中,化学能只转化为热能 |
| C.旧化学键断裂吸收的能量与新化学键形成所释放的能量的相对大小决定了反应是放热还是吸热 |
| D.吸热反应在常温下不能发生 |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y核外电子数的一半,Y与M可形成化合物 。下列说法正确的是( )
。下列说法正确的是( )
| A.还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
C.YX 、M 、M Y都是含有极性键的分子 Y都是含有极性键的分子 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
下列说法正确的是()
| A.化学反应既遵守“质量守恒”定律,也遵守“能量守恒”定律 |
| B.HF、HCl、HBr、HI的的稳定性依次增强 |
| C.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| D.两种粒子,如果核外电子排布相同,则它们互为同位素 |
下列说法正确的是()
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
| A.①③⑤ | B.②④⑥ | C.②③④ | D.①③⑥[ |
可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测说法正确的是()
| A.“类钫”在化合物中呈+1价 | B.“类钫”属过渡元素,具有放射性 |
| C.“类钫”单质的密度小于1g/cm3 | D.“类钫”单质有较高的熔点 |