依据下列事实:①X+Y2+=X2++Y;②Z+2H2O 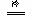 Zn
Zn 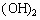 +H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为:W2++2e-=W,Y=Y2++2e-。可知X、Y、Z、W的还原性由强到弱的顺序是( )
+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为:W2++2e-=W,Y=Y2++2e-。可知X、Y、Z、W的还原性由强到弱的顺序是( )
| A.X>Z>Y>W | B.Z>W>X>Y |
| C.Z>Y>X>W | D.Z>X>Y>W |
对于可逆反应
 2C(g)
2C(g)  下列图象中正确的是()
下列图象中正确的是()
以 代表阿伏加德罗常数,则关于热化学方程式:C2H2(g) +
代表阿伏加德罗常数,则关于热化学方程式:C2H2(g) +  O2(g) ="===" 2 CO2(g) + H2O(l) △H="-1300" kJ/mol的说法中,正确的是()
O2(g) ="===" 2 CO2(g) + H2O(l) △H="-1300" kJ/mol的说法中,正确的是()
A.当有 个电子转移时,该反应放出 个电子转移时,该反应放出 的能量 的能量 |
B.当有 个碳氧共用电子对生成时,放出 个碳氧共用电子对生成时,放出 的能量 的能量 |
C.当有 个碳氧共用电子对生成时,放出 个碳氧共用电子对生成时,放出 的能量 的能量 |
D.当有 个水分子生成且为液体时,吸收 个水分子生成且为液体时,吸收 的能量 的能量 |
下列关于电离常数(K)的说法中正确的是( )
| A.电离常数(K)越小,表示弱电解质电离能力越弱 |
| B.电离常数(K)与温度无关 |
| C.不同浓度的同一弱电解质,其电离常数(K)不同 |
D.多元弱酸各步电离常数相互关系为 |
已知某温度下:

 △H=
△H= ,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是()
,恒温、恒容且容积相同的两个密闭容器A、B,A中通入1molN2、3 molH 2,B 中通入0.5 molN2、1.5 mol H 2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是()
A、A中放热
B、B中放热
C、A中热量变化值大于B中2倍
D、A中热量变化值等于B中的2倍
某二元酸(化学式用H2A表示)在水中的电离方程式为:H2A====H++HA-HA- H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是()
H++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是()
A.c(Na+)+ c(H+)= c(OH-)+ c(HA-)+ c(A2-)
B.c(Na+)+ c(OH-)= c(H+)+  c(HA-)
c(HA-)
C.c(Na+)="2" c(A2-)+2 c(HA-)+2 c(H2A)
D.c(A2-) + c(HA-)="0.1" mol·L-1