下列说法正确的是( )
| A.反应焓变是决定反应能否自发进行的唯一因素 |
| B.固体溶解过程与焓变有关 |
| C.温度、压强一定时,熵增加的反应一定自发进行的反应 |
| D.自发反应在恰当的条件下才能自发 |
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采 取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是
取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是
| A.只要在室内放一盆水 |
| B.向地势低的地方撤离 |
| C.观察风向,顺风撤离 |
| D.用湿毛巾或蘸有石碱水的毛巾捂住口鼻撤离 |
下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是
| A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOH |
| B.BaCl2和NaHSO4;Ba(OH)2和Na2SO4 |
| C.NaHCO3和NaHSO4;Na2CO3和NaHSO4 |
| D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量 |
从矿物学资料查得:当胆矾溶液渗入地下遇到硫铁矿时,可生成辉铜矿,化学方程式如下:
14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4对以上反应的下列分析正确的是
A.FeS2既是氧化剂,又是还原剂 |
| B.Cu2S是氧化产物,FeSO4是还原产物 |
| C.每生成1molCu2S时,CuSO4得到2mol电子 |
| D.被氧化与被还原的硫元素的质量之比为7︰3 |
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是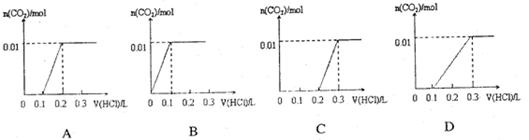
在a、b两支试管中加入体积相同的同种生铁块。在a中加入食盐水,塞上橡皮塞,如图。U型玻璃管内为红墨水(开始时两端液面等高)。放置一段时间后,下列叙述错误的是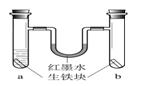
| A.生铁块中的主要成分是铁,也含有少量的碳 |
| B.红墨水柱两边的液面变为左低右高 |
| C.两试管中铁均被锈蚀 |
| D.a试管中发生的反应是:2C+2Fe+3O2=2FeCO3 |