对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1 ΔS=-280.3 kJ·mol-1·K -1,在常温、常压下反应能自发进行,对反应方向起决定性作用的是( )
| A.熵变 | B.温度 | C.压强 | D.焓变 |
氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷,工业上可用下列方法制取:
工业上可用下列方法制取:3SiO2+6C+2N2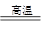 Si3N4+6CO.下列说法正确的是
Si3N4+6CO.下列说法正确的是
| A.氮化硅晶体属于分子晶体 |
| B.氮化硅中氮元素的化合价为-3 |
| C.上述反应中,N2是还原剂,SiO2是氧化剂 |
| D.上述反应中,每生成1mol Si3N4,N2得到6mol电子 |
下列说法正确的是
| A.分子式为H2O和D2O的性质相同 |
| B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a和途径b放出的热能相等 途径a:C  CO+H2 CO+H2 CO2+H2O CO2+H2O途径b:C  CO2 CO2 |
| C.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 |
| D.氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
下列有关硫元素及其化合物的表示正确的是
| A.质量数为34、中子数为18的核素:3416S |
B.S2-的结构示意图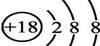 |
| C.CS2的结构式:S—C—S |
D.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
化学与科学、技术、社会、环境密切相关,下列说法错误的是
| A.神舟九号升空时火箭发射的动力主要来源于化学能 |
| B.洁厕灵的主要成分是盐酸,不能与“84”消毒液混用 |
| C.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |
| D.为了能增加水中氧气的含量,养金鱼用的自来水一般先在阳光下晒一段时间 |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0 mol•L-1的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |