往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O ]与氯化铵[NH4Cl]晶体,塞紧瓶塞。在木板上滴少量水,如下图所示。一会儿,就发现瓶内固态物质变成液体,瓶塞变冷,小木板上因少量水冻结而把烧瓶粘住,这时打开瓶塞,放出的气体有氨气的气味。这是自发的发生了吸热反应: 。这个现象说明下列结论正确的是
| A.自发反应一定是吸热反应 | B.自发反应一定是放热反应 |
| C.有的吸热反应也能自发进行 | D.吸热反应不能自发进行 |

下表为元素周期表的一部分,其中编号代表对应的元素。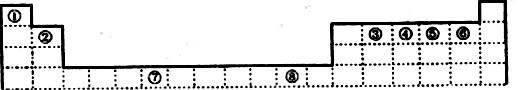
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的电子排布图为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,(写出一种即可)其VSEPR构型为 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中, 的配位数为 。
的配位数为 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1m ol(SCN)2分子中含有共价键的数目为 。
铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA的代数式表示)g· 。
。
合成氨是最重要的化工生产。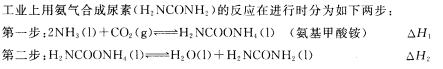
(1)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示: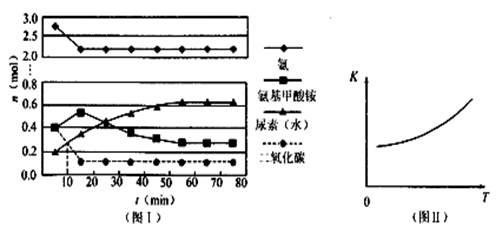
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 决定。
(2)合成氨反应N2(g)+3H2(g)=2NH3(g),使用催化剂反应的△H (填“增大”“减小”或“不改变”
(3)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即
 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入
现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入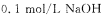 溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
(4 )拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,写出N2+3H2 2NH3反应的热化学方程式 ,
2NH3反应的热化学方程式 ,
I 铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2 = 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________,每生成l mol Na2FeO4转移____________mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________。
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
Reformatsky反应是利用醛与卤代酸酯反应制备羟基酸酯的常用简便方法,是形成碳碳健重要的有机反应。反应如下: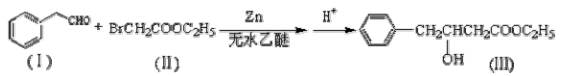
(1)化合物(Ⅰ)的一种同分异构体满足下列条件:①含有苯环;②核磁共振氢谱有4个峰,峰面积之比为1:2:2:3,其结构简式为 。
(2)化合物(Ⅲ)的分子式为 ,1mol该物质完全燃烧最少需要消耗 molO2.
(3)化合物(Ⅱ)所含官能团是 (名称),其在加热条件下与NaOH溶液反应的化学方程式是 。
(4)一定条件下,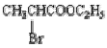 与过量的
与过量的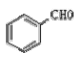 也可以发生Reformatsky反应,试写出该生成物的结构简式 。
也可以发生Reformatsky反应,试写出该生成物的结构简式 。
A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大。已知A原子核外有三个未成对电子;B的最外层电子数是内层电子数的3倍;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;R原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点高,理由是 。
(3)基态R+离子的核外电子排布式是 。
(4)Q分子是A2B的等电子体,Q的结构式为 。
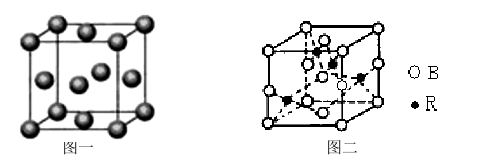
(5)图一是R单质的晶胞结构,配位数为 ;图二是B、R两元素组成的一种化合物的晶胞,其化学式为 。