⑴ 由钛铁矿(FeTiO3)提取金属钛(海绵钛)的主要工艺过程如下(部分产物省略):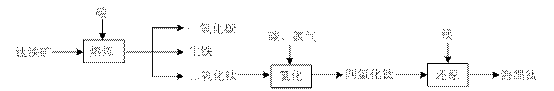
上述熔炼过程发生的反应为吸热反应,该反应能够自发进行的原因是 ▲ ;还原过程必须在1070K的温度下进行,你认为还应该控制的反应条件是 ▲ 。
⑵ 用浓硫酸处理钛铁矿,并向所得溶液中加入铁,此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
| Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于 ▲ 时,Mg(OH)2开始沉淀。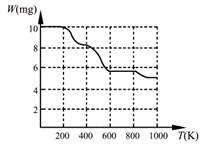 若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量
白色沉淀,写出该反应的离子方程式: ▲ 。
⑶ BaTiO3是一种可用来吸收低频波的无机功能材料。工业上,常用
BaCl2、TiCl4、H2O和H2C2O4混合反应生成白色固体A,将该白色
固体加热分解至900K可得BaTiO3,实验测得其热分解过程的质量
-温度关系曲线如右图所示,图中400K、600K和900K时对应的
样品的质量分别为8.38mg、5.68mg和5.19mg。白色固体A的化学式
为 ▲ (填序号)。
a.BaTi2O5 b.BaC2O4·2H2O c.BaTi(C2O4)3 d.BaTiO (C2O4)2·4H2O
下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)()
欲观察环戊烯 ( ) 是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol·L-1 KMnO4溶液并不断振荡。下列哪一种试剂最适合用来溶解环戊烯做此实验()
) 是否能使酸性KMnO4溶液褪色,先将环戊烯溶于适当的溶剂,再慢慢滴入0.005mol·L-1 KMnO4溶液并不断振荡。下列哪一种试剂最适合用来溶解环戊烯做此实验()
| A.甲苯 | B.裂化汽油 | C.四氯化碳 | D.水 |
下列除杂(括号内为杂质)有关操作,其中正确的是()
| A.苯 (苯酚)—— 加入适量浓溴水,过滤 |
| B.(NO2)——通过水洗、干燥后,用向下排空气法收集 |
| C.乙烷 (乙烯)——让气体通过盛有酸性高锰酸钾溶液的洗气瓶 |
| D.乙醇 (乙酸)——加足量CaO固体,蒸馏 |
在人们的印象中,塑料是常见的绝缘材料,但2000年三名诺贝尔化学奖得主的研究成果表明,塑料经改造后能像金属一样具有导电性,要使塑料聚合物导电,其内部的碳原子之间必须交替地以单键和双键结合(再经掺杂处理)。目前导电聚合物已成为物理学家和化学家研究的重要领域.由上述分析,下列聚合物经掺杂处理后可以制成“导电塑料”的是()
某有机物的结构简式为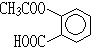 ,它可以发生的反应类型有()
,它可以发生的反应类型有()
①取代②加成③消去④酯化⑤水解⑥中和 ⑦缩聚⑧加聚
| A.只有①②④⑤ | B.只有①②④⑤⑥ |
| C.只有①②④⑤⑥⑦ | D.只有①②④⑤⑥⑧ |