对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
| A.溶液中加入稀HNO3后,再加入AgNO3溶液,有白色沉淀生成,则溶液中可能含有Cl- |
| B.溶液中加入BaCl2溶液有白色沉淀,再加入稀HNO3溶液,沉淀不溶解,则溶液中可能含有SO2-4 |
| C.溶液中加入NaOH溶液,产生蓝色的沉淀,则可推知该溶液中可能含有Cu2+ |
| D.向溶液中加入稀HCl,有使澄清的石灰水变浑浊的无色无味的气体放出,可推知该液中可能含有CO2-3 |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的DH>0 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH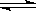 CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,反应速率增大,平衡向逆反应方向移动 |
| C.滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为
| A.1:1 | B.1:2 | C.1:10 | D.10:1 |
在密闭容器中进行如下反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
| A.T1>T2,ΔH>0 |
| B.T1>T2,ΔH<0 |
| C.T1<T2,ΔH>0 |
| D.T1<T2,ΔH<0 |
在一定温度下,反应A2(g)+B2(g) 2AB(g) 达到平衡状态的标志是
2AB(g) 达到平衡状态的标志是
| A.单位时间生成n molA2同时生成n molAB |
| B.容器内的总压强不随时间变化 |
| C.单位时间生成2n molAB同时生成n molB2 |
| D.单位时间生成n molA2同时生成n molB2 |