有一小块钠久置于空气中,最后生成的产物是( )
| A.Na2O2 | B.NaHCO3 | C.Na2CO3 | D.Na2CO3·10H2O |
下列有关晶体的叙述中,正确的是
| A.在CaF2晶体中,Ca2+、F—的配位数均为8 |
| B.C60晶体中,微粒之间通过共价键结合形成晶体,键角为120° |
| C.在CsCl晶体中,每个Cs+周围紧邻6个C1— |
| D.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 |
科学家发现铂的两种化合物a和b(见下图),实验测得a和b具有不同的性质,且a具有抗癌作用,而b没有。下列关于a、b的叙述错误的是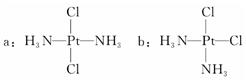
| A.a和b互为同分异构体 | B.a和b互为“镜”和“像”的关系 |
| C.a和b的空间构型是平面四边形 | D.a和b分别是非极性分子和极性分子 |
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
| 选项 |
混合物 |
试剂 |
分离方法 |
| A. |
溴乙烷(乙醇) |
生石灰 |
蒸馏 |
| B. |
甲烷(乙烯) |
酸性高锰酸钾溶液 |
洗气 |
| C. |
苯(硝基苯) |
蒸馏水 |
分液 |
| D. |
苯甲酸(NaCl) |
蒸馏水 |
重结晶 |
下列各项性质,属于C2H6、C2H4、C2H2共性的是
| A.常温常压下是无色无味气体 | B.在通常状况下,密度比空气小 |
| C.能使酸性KMnO4溶液褪色 | D.在一定条件下能发生加聚反应 |
下列有机物的系统命名正确的是
| A.2,2-二甲基丁烷 | B.2—乙基—2—丁烯 |
| C.2-甲基-1-乙基苯 | D.2,2-二甲基-3-戊炔 |