0.1 mol某单质跟足量的硫充分反应后,质量增加1.6 g,则组成这种单质的元素是
| A.铁 | B.铜 | C.铝 | D.镁 |
A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )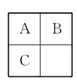
A.B与C均不存在同素异形体
B.X一定是酸性氧化物
C.B的氢化物比A、C的氢化物稳定
D.A与B形成的化合物X有3种
已知A、B、C、D、E是短周期元素,原子序数依次增大。其中A、E的单质在常温下呈气态, B的原子最外层电子数是其电子层数的2倍, C在同周期主族元素中原子半径最大, D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A.B位于元素周期表中第二周期第ⅥA族
B.工业上可以用电解CE溶液的方法同时获得C、E单质
C.C、D的最高价氧化物对应的水化物之间能发生化学反应
D.化合物AE与CE具有相同类型的化学键
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )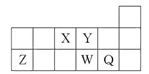
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.L电子层电子数为奇数的所有元素都是非金属 |
| B.第三、四、五、六周期元素的数目分别是8、18、32、32 |
| C.由左至右第8、9、10三列元素中没有非金属元素 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图所示,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
| A.原子半径:Y>Z>X |
| B.气态氢化物的热稳定性:X<Z |
| C.Y和Z的最高价氧化物对应水化物均为强酸 |
| D.若Z的最高正价为+m,则X的最高正价也一定为+m |