含有硒(Se)的保键品已进入市场,已知该元素与氧具有相同的最外层电子数。则下列关于硒的叙述中不正确的是
| A.最高价氧化物的化学式为SeO3 |
| B.单质Se是一种半导体材料 |
| C.原子半径比硫大,比溴大 |
| D.单质的氧化性比氯气弱,比溴强,比O3弱 |
某有机化合物的结构简式为: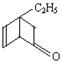 ;其中属于芳香醇的同分异构体共有
;其中属于芳香醇的同分异构体共有
| A.3种 | B.4种 | C.5种 | D.6种 |
C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列相等的是
| A.2个-CH3,能生成6种一氯代物 |
| B.3个-CH3,能生成4种一氯代物 |
| C.2个-CH3,能生成5种一氯代物 |
| D.4个-CH3,能生成4种一氯代物 |
已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误的是
| A.在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出 |
| B.往氯化银的悬浊液中加硝酸银,c(Cl—)、c(Ag+)均减小 |
| C.由于Ksp(AgCl)>Ksp(AgI),AgCl沉淀在一定条件下可转化为AgI沉淀 |
| D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g),△H=-92.6 kJ·mol-1
2XY3(g),△H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
下列各表述与示意图一致的是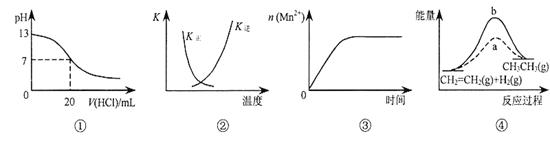
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g)+ O2(g) 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+ H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |