某化学课外活动小组,从化学手册上查得硫酸铜在500℃以上按下式分解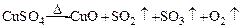 ,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如图所示:
,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如图所示: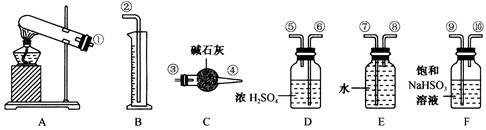
实验测得数据及有关结果如下:
①准确称取6.0g无水CuSO4;②干燥管总质量在实验结束时增加了2.4g;③测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质)。
试回答下列问题:
(1)按装置从左至右的方向,各仪器接口连接顺序为____________________(填序号)。
(2)装置F的作用是_______________________________________________________。
(3)装置D的作用是_______________________________________________________。
(4)确定装置E的进、出口的原则是_____________________________。
(5)首先应计算的是物质__________的体积;通过计算,推断出该条件下反应的化学方程式:_______________________________________________________。
(6)该实验设计中,可能给测定带来误差最大的装置是(填代号)________________。
在灰黑色粉末A和白色粉末B组成的混合物中加水,先看到蓝色溶液,过一段时间溶液变为浅绿色,并同时析出红色沉淀C。将沉淀C过滤出来,加入浓硫酸共热,有气体放出,将溶液浓缩,结果得到晶体D,把晶体D继续加热,又得到白色粉末B。试推断A、B、C、D的化学式:
A:________,B:________C:________D:________。
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、
OH-、NO3—六种离子。甲厂排放的废水明显呈碱性,故甲厂废水中所含的三种离子是______、______、______;乙厂排放的废水中含有另外三种离子。如果加一定量的______(填“活性炭”、“硫酸亚铁”或“铁粉”),可以回收其中的金属______(填金属元素的符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含______(填化学式),可用来浇灌农田。
已知煤的近似结构模型为: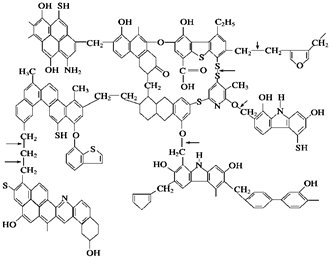
(1)从煤的结构模型来看,煤是工业上获得________烃的重要来源;
(2)我国大约70%的煤是直接用于燃烧的,从煤的结构模型来看,在提供热量的同时产生大量的________、________等气体物质,造成严重的大气污染;
(3)“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐,下列物质中适宜于作固硫剂的是________。
| A.氯化钙 | B.氧化钙 | C.硫酸钙 | D.氢氧化钙 |
(4)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程:________________________________________________________________________,
(10分)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下: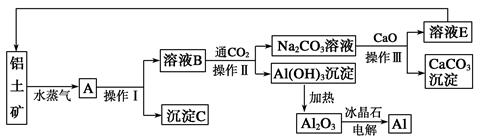
请回答下列问题:
(1)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________。
(2)电解熔融的氧化铝时,若得到标准状况下22.4 L O2,则同时生成________g铝。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称),实验室要洗涤Al(OH)3沉淀应该在________装置中进行,洗涤方法是______________________________________
________________________________________________________________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
(5)写出Na2CO3溶液与CaO反应的离子方程式:________________________________。
(6)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:________(填化学式)。
(8分)A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种;并有如下图所示的转化关系。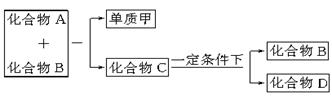
其中D是日常生活中常见的有机化合物,在一定条件下,可与单质甲进一步发生如下变化:D+3甲→3A+2B。试回答以下问题:
(1)在A、B、C、D四种化合物中,所含元素种类完全相同的是__________(写字母代码和物质名称)。
(2)在常温下,A和B通过__________作用转化为C。
(3)目前,化合物B在自然界中的含量呈上升趋势,对于环境产生了不良影响,发生这种变化的主要原因是______________________________。