将由CaCO3、MgCO3组成的混合物充分加热至质量不再减少时,称得残留物的质量为原混合物的一半,则残留物中Ca、Mg两元素原子的物质的量之比是多少?
现将芒硝(化学式为Na2SO4·10H2O)48.3 g配成2 L溶液,求该溶液中Na2SO4的物质的量浓度。
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,其正极反应为____________________________,
负极反应为__________________________________________;
(2)若电解质溶液为硫酸,其正极反应为______________________,负极反应为_________________;若在常温下转移2mol电子,可产生水质量为_________g。
(3)若用氢氧燃料电池做电源电解由NaCl和CuSO4组成的混合溶液,其中
c(Na+)=3c(Cu2+)=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。计算(写出计算过程)
此时氢氧燃料电池中消耗H2和O2的质量各是多少?(保留2位小数)
将2.5 g Na2CO3、NaHCO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示: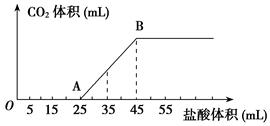
(1)写出OA段所发生反应的离子方程式___________________。
(2)当加入35 mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)计算原混合物中NaOH及碳酸钠的质量。
某研究性学习小组用48.0克铜屑与氧化铜的混合物与硫酸和硝酸的混酸100 ml溶液反应制取五水硫酸铜晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后溶液中只有硫酸铜。若在固体混合物中铜屑的质量分数为0.4,试计算:(1)最终制得晶体的质量。(2)混酸中两溶质的物质的量浓度。
(6分)将100mL 0.40mol·L—1的BaCl2溶液与200mL 0.75mol·L—1的H2SO4溶液混合后,可得克沉淀。滤去沉淀后(忽略溶液体积的变化,在滤液中加入足量的Na2CO3固体,可得到标准状况下的气体升。