试根据碱金属元素性质的递变规律推测下列说法,其中不正确的是( )
| A.Cs2CO3比CsHCO3稳定 | B.CsOH是一种强碱 |
| C.可能存在Cs2O2 | D.Cs在金属活动性顺序表中排在K后面 |
某有机化合物的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为51.52%,其余为氧,该化合物分子中最多含多少个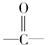 结构
结构
| A.1个 | B.2个 | C.3个 | D.4个 |
某有机化合物的结构简式为 ,有关该化合物的叙述不正确的是
,有关该化合物的叙述不正确的是
| A.该有机物的分子式为C11H12O2 |
| B.1 mol该物质最多能与4 mol H2发生加成反应 |
| C.该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
| D.该有机物一定条件下,可以发生取代、氧化、酯化反应 |
已知:C(s)+H2O(g)=CO(g)+H2(g),ΔH=+130 kJ·mol-1
2C(s)+O2(g)=2CO(g),ΔH=-220kJ·mol-1
H-H、O=O键能分别为436、496 kJ·mol-1,则O-H键能为
| A.222 kJ·mol-1 | B.444 kJ·mol-1 |
| C.462 kJ·mol-1 | D.924 kJ·mol-1 |
铝粉和铁红的混合物分成两等份,一份直接放入足量的烧碱溶液中;另一份在高温下恰好完全反应,产物再与足量盐酸充分反应。则两种情况下生成的气体体积比(相同条件)是
| A.2:3 | B.3:2 | C.1:1 | D.2:1 |
在一定温度下,10mL0.50mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| V(O2)/mL |
0.0 |
9.9 |
17.2 |
22.4 |
26.5 |
29.1 |
下列叙述正确的是(溶液体积变化忽略不计)
A.0~6 min的平均反应速率:v(H2O2)≈0.33 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)>3.3×10-2 mol/(L·min)
C.反应到6 min时,H2O2分解了60%
D.反应到10 min时,c(H2O2) ≈0.24 mol/L