| A.服用大量开水 |
| B.服用足量的牛奶 |
| C.服用足量的酒精 |
| D.服用足量的硫化钠 |
X、Y、Z、W有如右图所示的转化关系,则X、Y可能是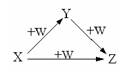
① C、CO ② AlCl3、Al(OH)3
③ Fe、Fe(NO3)2 ④ Na2CO3、NaHCO3
A.①②③ B.①② C.③④ D.①②③④
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,则下列判断正确的是……………………………..
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ ②有胶状物质生成 ③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
| A.①③⑤ | B.②③④ | C.①②③④ | D.②④⑤ |
下列离子方程式正确的是
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| B.一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ |
| C.Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32- |
| D.Na2CO3溶液中加入醋酸:CO32-+2H+=CO2↑+H2O |
仅通过物理方法就能从海水中获得的物质是
| A.钠、镁 | B.溴、碘 | C.食盐、淡水 | D.氯气、烧碱 |
化学与生活、社会密切相关。下列说法正确的是()
| A.用NaOH溶液雕刻工艺玻璃上的纹饰 |
| B.Na2O可用于呼吸面具中作为氧气的来源 |
| C.工业上硝酸可用于制化肥、农药、炸药和染料等 |
| D.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |