| A.含磷洗衣粉 | B.酒精 | C.氟利昂 | D.含汞电池 |
对于达到平衡状态的可逆反应:N2 +3H2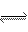 2NH3 ,下列有关叙述正确的是
2NH3 ,下列有关叙述正确的是
| A.反应物和生成物浓度不再发生变化 | B.反应物和生成物的浓度相等 |
| C.N2和NH3的质量分数相等 | D.正反应和逆反应不再进行 |
下列说法中错误的是
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热 |
雷雨天闪电时空气中的臭氧(O3)生成,下列说法正确的是
| A.O2和O3互为同位素 |
| B.O2和O3的相互转化是物理变化 |
| C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数 |
| D.等物质的量的O2和O3具有相同的质子数 |
美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为
| A.47 | B.57 | C.61 | D.175 |
丁烷、甲烷、乙醛的混和气体在同温同压下和CO2的密度相同,若其中丁烷占总体积的25%,则三种气体的体积比为
| A.1∶2∶5 | B.5∶2∶1 | C.2∶5∶1 | D.2∶1∶5 |