| A.有机物 | B.金属或合金 | C.氧化物 | D.盐 |
下列有关叙述中不正确的是
| A.相同温度下,0.02 mol·L-1的醋酸溶液与0.01 mol·L-1的醋酸溶液中的c(H+)之比小于2 :1 |
| B.相同温度下,0.1 mol·L-1 (NH4)2SO4溶液与0.1 mol·L-1 NH4NO3溶液中c(NH4+)之比大于2 :1 |
| C.在0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 |
| D.40 ℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2 :1 |
在1升密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:(1)2A(g) 2B(g)+C(g);(2)A(g)
2B(g)+C(g);(2)A(g) C(g)+D(g)。当达到平衡时,测得c(A)="2.5" mol·L-1,c(C)="2.0" mol·L-1。则下列说法中正确的是:
C(g)+D(g)。当达到平衡时,测得c(A)="2.5" mol·L-1,c(C)="2.0" mol·L-1。则下列说法中正确的是:
A.达到平衡时A的总转化率为40%
B.达到平衡时c(B)为1.0 mol·L-1
C.达到平衡时c(B)=2c(D)
D.达到平衡时c(D)为0.5 mol·L-1
如图是达到平衡后,外界条件变化时,2SO2(g)+O2(g) 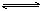 2SO3(g);
2SO3(g);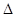 H<0反应速率的变化情况(
H<0反应速率的变化情况(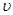 /表示正反应速率,
/表示正反应速率, 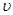 //表示逆反应速率)。下列说法中正确的是
//表示逆反应速率)。下列说法中正确的是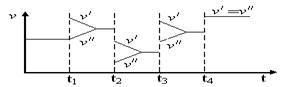
| A.t1时改变的条件是增大体系的压强 | B.t2时改变的条件是减小压强 |
| C.t3时改变的条件是升高温度 | D.t4时改变的条件是使用了催化剂 |
(B)分子式为C6H12O2,属于乙酸乙酯同系物的同分异构体共有
A.12种 B.16种 C.20种 D.24种
(A)下列分子中,VSEPR模型名称和分子立体构型名称相同,且分子中各原子最外层都满足8电子稳定结构的是
A.CH4B.PCl3 C.SiCl4 D.XeF4