某学生课外活动小组利用右图所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
(12分)锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
(1)锌浮渣利用硫酸浸出后,将滤渣1进行再次浸出,其目的是____。
(2)净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:____。
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如右图所示。pH较小时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是____________________________。
(4)滤渣3的主要成分为________(填化学式)。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:____;碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,二是____________。
【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0. 010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是 。抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是 ,滴定终点溶液的颜色呈 色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是 。
(4)1kg卷心菜中所含维生素C相当于 片上述维生素药片。(用含V1、V2的代数式表示)
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4·5H2O)。
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是。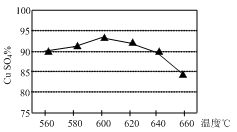
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。
①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm—3)的H2O2来配制,其具体配制方法是。
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步:。
第三步:,过滤。
第四步:、冷却结晶。
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为。
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是。抽滤所用的滤纸应略(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是,滴定终点溶液的颜色呈色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是。
(4)1kg卷心菜中所含维生素C相当于片上述维生素药片。(用含V1、V2的代数式表示)
硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:
(1)写出反应Ⅰ的离子方程式:(任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是,可采取的措施为。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是。
(5)若用下图所示实验装置制取Al(NO3)3,通入水蒸气的作用是。