用1 L 1.0 mol·L-1 NaOH溶液吸收0.8 mol CO2,所得溶液中的CO 和HCO
和HCO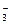 的浓度之比约是
的浓度之比约是
| A.1∶3 | B.1∶2 | C.2∶3 | D.3∶2 |
常温下,若HA溶液和NaOH溶液混合后pH =7,下列说法不合理的是
| A.反应后HA溶液可能有剩余 |
| B.生成物NaA的水溶液的pH可能小于7 |
| C.HA溶液和NaOH溶液的体积可能不相等 |
| D.HA溶液的c(H+)和NaOH溶液的c(OH -)可能不相等 |
N2(g)+3H2(g) 2NH3(g)△H<0。当反应达到平衡时,下列措施能提高N2转化率的是
2NH3(g)△H<0。当反应达到平衡时,下列措施能提高N2转化率的是
① 降温② 恒压通入惰性气体③ 增加N2的浓度④ 加压
| A.①④ | B.①② | C.②③ | D.③④ |
下列叙述正确的是
| A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023 |
| B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =" 0.1" mol/L |
C.1 L 0.1 mol/L NH4Cl溶液中的NH 数是0.1×6.02×1023 数是0.1×6.02×1023 |
| D.标准状况下2.24 L Cl2中含有0.2 mol 共价键 |
关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O H3O++CO32- H3O++CO32- |
| B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-) |
| D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)] |
下列与金属腐蚀有关的说法中,不正确的是
| A.钢铁在潮湿空气中生锈属于电化学腐蚀 |
| B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 |
| C.金属腐蚀的本质是金属原子失去电子被氧化的过程 |
| D.铝具有强抗腐蚀能力,是因为其不易与氧气发生反应 |