对于可逆反应2NO2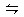 N2O4,下列说法能证明反应已达平衡状态的是
N2O4,下列说法能证明反应已达平衡状态的是
⑴温度和体积一定时,某一生成物浓度不再变化;
⑵温度和体积一定时,容器内压强不再变化;
⑶条件一定,混合气体的平均相对分子质量不再变化;
⑷温度和体积一定时,混合气体的颜色不再发生变化;
⑸温度和压强一定时,混合气体的密度不再发生变化;
反应CO(g)+2H2(g)  CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是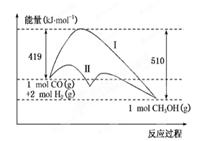
| A.该反应的ΔH=+91 kJ/mol |
| B.加入催化剂,正、逆反应的活化能数值均减小 |
| C.加入催化剂,该反应的ΔH变小 |
| D.如果该反应生成液态CH3OH,则ΔH变大 |
工业生产苯乙烯是利用乙苯的脱氢反应:
下列说法错误的是
| A.该反应中生成物的总能量高于反应物 |
| B.增大压强反应物活化分子百分数不变 |
| C.升高温度可以提高原料乙苯的转化率 |
| D.不断分离出苯乙烯可加快反应速率 |
下图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |
下列热化学方程式正确的是( 的绝对值均正确)
的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
下列化学用语的表达正确的是
A.原子核内有10个中子的氧原子: |
B.氯原子的结构示意图: |
| C.Fe3+的最外层电子排布式为:3s23p63d5 |
D.基态铜原子的外围电子排布图: |