为了测定乙醇的分子结构,有人设计了下图所示的用无水乙醇与钠反应的实验装置和测定氢气体积的测量装置,可供选用的实验仪器如下: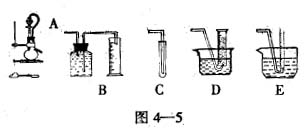
(1)测量气体体积的正确装置是 (填写编号)
(2)装置中A部分的分液漏斗与蒸馏烧瓶间连接的导管所起的作用是 (填写编号)
(A)防止无水酒精挥发
(B)保证实验装置不漏气
(C)使无水酒精容易滴下
(3)实验前先将小块钠在二甲苯中熔化成钠珠,冷却后倒入烧瓶中。其目的是 。
(4)已知无水酒精的密度为0.789gcm-3,又2.Oml酒精反应完全后(钠过量),收集气体39Oml。则乙醇分子中能被钠取代出的氢原子为 ,由此可确定乙醇的结构式为 而不是 。
(5)实验所测定的结果偏高。可能引起的原因是 (填写编号)
(A)本实验在室温下进行,
(B)无水酒精中混有微量甲醇
(C)无水酒精与钠的反应不够完全
X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物
;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是。
(2)利用价层电子对互斥理论判断TU3的立体构型是。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是(填化学式);Z和U的氢化物中沸点较高的是(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是(填化学式)。
(4)
溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是。
)甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
完成下列填空:
1.将4.00
甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100
的硫酸滴定,至终点时耗用硫酸20.00
。
甲醛水溶液的浓度为
。
2.上述滴定中,若滴定管规格为50
,甲醛水溶液取样不能超过
。
3.工业甲醛含量测定的另一种方法:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定。
+
→
+
+
→
+
已知
能氧化甲酸生成二氧化碳和水。
如果
用量不足,会导致甲醛含量的测定结果(选填"偏高"、"偏低"或"不受影响"),因为;如果
过量,会导致甲醛含量的测定结果(选填"偏高"、"偏低"或"不受影响"),因为。
4.甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
+
 +
↓ +
若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
+
↓ +
若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
①主要仪器:试管 酒精灯
②可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
27.写出电解饱和食盐水的离子方程式。
28.离子交换膜的作用为:、。
29.精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出(选填"a"、"b"、"c"或"d")。
30.
可以和草酸(
)、硫酸反应生成高效的消毒杀菌剂
,还生成
和
等物质。
写出该反应的化学方程式。
31.室温下,0.1 mol/L
溶液的pH0.1 mol/L
溶液的pH(选填"大于"、"小于"或"等于")。浓度均为0.1 mol/L 的
和
的混合溶液中,
、
、
、
浓度从大到小的顺序为。
已知:
Ki1=1.54×10-2 Ki2=1.02×10-7
Ki1=2.95×10-8
Ki1=4.3×10-7 Ki2=5.6×10-11
白云石的主要成份是
,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现
、
的分离。碳化反应是放热反应,化学方程式如下:
完成下列填空
23.
的碱性比
的碱性(选填"强"或"弱")
的溶解度比
的溶解度(选填"大"或"小")
24.碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是、。温度偏低也不利于碳化反应,原因是。
25.已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10
到13
之内钙离子的反 应速率为。15
之后钙离子浓度增大,原因是(用化学方程式表示)。
26.
原子核外电子排布式为;
原子最外层电子的能量
原子最外层电子的能量(选填"低于"、"高于"或"等于")。
氟在自然界中常以
的形式存在。
(1)下列关于
的表述正确的是。
a.
与
间仅存在静电吸引作用
b.
的离子半径小于
,则
的熔点高于
c.阴阳离子比为2:1的物质,均与
晶体构型相同
d.
中的化学键为离子键,因此
在熔融状态下能导电
(2)
难溶于水,但可溶于含
的溶液中,原因是(用离子方程式表示)。
已知
在溶液中可稳定存在。
(3)
通入稀NaOH溶液中可生成
,
分子构型为,其中氧原子的杂化方式为。
(4)
与其他卤素单质反应可以形成卤素互化物,例如
、
等。已知反应
,
键的键能为
,
键的键能为
,则
中
键的平均键能为
。
的熔、沸点比
的(填"高"或"低")。