甲基丙烯酸酯是世界上年产量超过100万吨的高分子单体.旧法合成的反应是:
(CH3)2C=O+HCN→(CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
90年代新法的反应是:
CH3CH=CH2+CO+CH3OH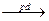 CH2= C(CH3)COOCH3与旧法比较,新法的优点是
CH2= C(CH3)COOCH3与旧法比较,新法的优点是
| A.原料无爆炸危险 | B.原料都是无毒物质 |
| C.没有副产物,原料利用率高 | D.对设备腐蚀性较小 |
检验盐溶液中是否含有某种离子,下列方法正确的是
| A.加入AgNO3溶液,有白色沉淀生成,则证明含有Cl- |
| B.加入BaCl2溶液,产生白色沉淀,则证明有SO42- |
| C.加入盐酸,放出能使澄清石灰水变浑浊的气体,则证明有CO32- |
| D.加浓NaOH溶液后加热,有使湿润的红色石蕊试纸变蓝的气体产生,则证明有NH4+ |
下列说法不正确的是
| A.将废弃塑料焚烧是治理“白色污染”的合理途径 |
| B.石灰石是制造水泥、玻璃共同用到的原料 |
| C.纯净的二氧化硅是现代光学及光纤制品的基本材料 |
| D.含有氯化钠融雪剂的使用会加快桥梁的腐蚀 |
将200 g NaHCO 和78 g Na
和78 g Na O
O 混合后放在密闭容器中加热使之充分反应,然后趁热排出气体物质,则容器中残留物的成分是()
混合后放在密闭容器中加热使之充分反应,然后趁热排出气体物质,则容器中残留物的成分是()
A.Na O O 和NaHCO 和NaHCO |
B.NaHCO 和Na 和Na CO CO |
C.NaOH和Na CO CO |
D.只有Na CO CO |
有两种碳酸盐组成的混合物11 g,与足量盐酸充分反应生成CO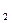 4.4 g,该混合物的可能组成是… ()
4.4 g,该混合物的可能组成是… ()
A.NaHCO 和Na 和Na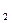 CO CO |
B.NaHCO 和KHCO 和KHCO |
C.KHCO 和K 和K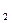 CO CO |
D.MgCO 和KHCO 和KHCO |
可用于判断碳酸氢钠粉末中是否混有碳酸钠的实验方法是()
| A.溶于水后滴加氯化钡稀溶液,有无白色沉淀生成 |
| B.溶于水后滴加澄清石灰水,有无白色沉淀生成 |
| C.加热时有无气体放出 |
| D.滴加盐酸时有无气泡产生 |