| A.自来水 |
| B.0.5 mol·L-1盐酸 |
| C.0.5 mol·L-1 CH3COOH溶液 |
| D.0.5 mol·L-1 KCl溶液 |
现有物质的量浓度均为0.1 mol/L的下列5种物质的水溶液:①HNO3②H2SO4③CH3COOH④ NaOH其溶液中由水电离出的c(H+)的大小关系是
| A.③>①=④>② | B.③=①=④>② |
| C.②>①>③>④ | D.③>①>④>② |
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0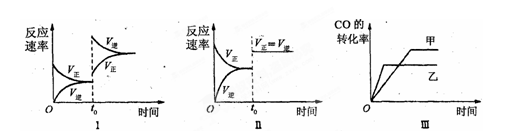
下列分析中正确的是
| A.图Ⅰ研究中的是t0时增大反应物浓度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且甲的温度较高 |
下列叙述正确的是









| A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
下列有关热化学方程式的叙述正确的是
| A.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)==2CO(g)+O2(g)反应的 △H=2×283.0kJ/mol |
C.在稀溶液中H+(aq)+OH-(aq)  H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ |
D.己知2H2(g)+O2(g) 2H2O(l)△H1 , 2H2O(l)△H1 , |
2H2(g)+O2(g) 2H2O(g)△H2 ,则△H1 > △H2
2H2O(g)△H2 ,则△H1 > △H2
一定条件下,在一恒容密闭容器中,能表示反应 X(g) + 2Y(g)  2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化② X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.②③ | C.③④ | D.①④ |