实验室可以通过三条途径来制取氮气:
①加热条件下用NH3还原CuO制得纯净的N2和活性铜粉,反应的化学方程式为:
② 将空气通过灼热的活性铜粉制得较纯净的N2
③ 加热NaNO2(有毒性)与NH4Cl的混合浓溶液制取N2,反应的化学方程式为:
按上述途径制N2可供选择的实验仪器如下图所示,其他必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等未列出。
(l)按途径 ① 制取N2时所需的氨气要用浓氨水与生石灰作原料制取,化学方程式为: ,最好要用上述仪器中 的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
,最好要用上述仪器中 的(填仪器字母,下同)作为氨气发生装置。要制取并收集纯净的N2(允许含少量的水蒸气),还应使用到上述仪器中的
(2) ① 和 ② 两种途径常常被协同使用。这种方法与途径 ③ 相比优点是
(3)检查 E 装置气密性的方法是 。利用 E 装置还可以制取的气体有 (写出三种)。
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2) (1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。 孔雀石__________________________;石青__________________________;
孔雀石__________________________;石青__________________________; (2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________; (2)实验中观察到的主要现象是:
(2)实验中观察到的主要现象是: ①_______________________________;
①_______________________________; ②_______________________________;
②_______________________________; ③_______________________________;
③_______________________________; ④_______________________________。
④_______________________________。 (3)用该装置做铜与浓硝酸反应实验的优点:______________;
(3)用该装置做铜与浓硝酸反应实验的优点:______________; (4)大烧杯内最终所得气体产物的化学式:;若要验证此气体产物,最简便的方法:_________________________________________。
(4)大烧杯内最终所得气体产物的化学式:;若要验证此气体产物,最简便的方法:_________________________________________。
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.
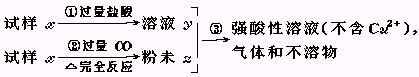
 (1)请写出步骤③中所发生的全部反应的离子方程式.
(1)请写出步骤③中所发生的全部反应的离子方程式. (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为(用m表示).
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为(用m表示).
mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经 氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
氢气还原所得红色产物中是否含有碱性氧化物Cu2O。