某同学想用实验证明高锰酸钾溶液的紫红色是MnO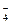 离子的颜色,而不是K+离子的颜色,他设计的下列实验步骤中没有意义的是
离子的颜色,而不是K+离子的颜色,他设计的下列实验步骤中没有意义的是
| A.将高锰酸钾晶体加热分解,所得固体质量减少 |
| B.观察氯化钾溶液没有颜色,表明溶液中K+无色 |
| C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应 |
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO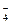 离子为紫红色 离子为紫红色 |
质量数为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为 ()
A. mol mol |
B. mol mol |
| C.(A-N+8)mol | D. mol mol |
下列说法正确的是( )
A.12C、13C、14C、金刚石、石墨都是碳元素的同位素
B.同种元素的原子,质量数一定相同
C.互为同位素的原子,质子数一定相同
D.由一种元素组成的物质,一定是纯净物
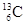 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。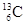 表示的碳原子
表示的碳原子
| A.核外有13个电子,其中4个能参与成键 |
| B.核内有6个质子,核外有7个电子 |
| C.质量数为13,原子序数为6,核内有7个质子 |
| D.质量数为13,原子序数为6,核内有7个中子 |
原子结构模型的演变图中,①为道尔顿实心球式原子模型、②为卢瑟福带核的原子模型、③为汤姆生葡萄干面包式原子模型、④为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是( )
①②③④
| A.①③②④ | B.①②③④ |
| C.①④③② | D.①③④② |
将一小块金属钠久置于空气中,有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是()
| A.①②③④ | B.④③②① | C.②③④① | D.①③④② |