铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
| A.Fe(OH)3;Fe2O3 | B.Fe(OH)2;FeO |
| C.Fe(OH)2;Fe(OH)3;Fe3O4 | D.Fe2O3;Fe(OH)3 |
常温常压下pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是()
| A.11∶1 | B.9∶1 | C.1∶11 | D.1∶9 |
如图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为()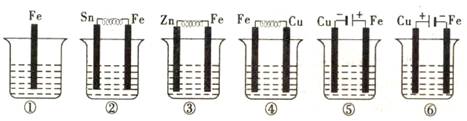
A.⑤④②①③⑥B.⑤④③①②⑥C.②①③④⑤⑥D.⑤③②④①⑥
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H="a" kJ/mol(a >0),该温度下K = 0.263,下列有关该反应的说法正确的是()
| A.若生成1 mol Fe,则吸收的热量小于a kJ |
| B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L |
中央电视台报道,一种名叫“排毒基强离子排毒仪”的产品正在市场热销。向排毒盆内倒入了纯净的温水,双脚放入盆中,启动电源开关,加入了适量精盐。过一段时间,盆中开始出现绿色、红褐色的絮状物。下列说法正确的是 ( )
| A.此“排毒基强离子排毒仪”一定是用惰性电极制成的 |
| B.绿色、红褐色的絮状物是氢氧化亚铁、氢氧化铁形成的混合物 |
| C.绿色、红褐色的絮状物就是从脚底排出的体内毒素 |
| D.加一些精盐的主要目的只是起到消炎杀菌的作用 |
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是()
| A.放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4 |
| B.放电时,LiMn2O4发生氧化反应 |
| C.充电时,阳极反应为:Li++e-=Li |
| D.充电时,LiMn2O4发生氧化反应 |