A.c(Na+)=2c(CO ) ) |
B.c(OH-)=2c(H+) |
C.c(HCO )>c(H2CO3) )>c(H2CO3) |
D.c(Na+)<c(CO )+c(HCO )+c(HCO ) ) |
已知:C(s)+O2(g)=CO2(g)△H1 CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3 4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是 ( )
| A.△H1>0,△H3<0 | B.△H2>0,△H4>0 |
| C.△H1=△H2+△H3 | D.△H3=△H4+△H5 |
在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是
| A.8.7g二氧化锰与50mL8mol·L-1浓盐酸共热制取氯气 |
| B.19.2g铜与100mL12mol·L-1的硝酸反应 |
| C.常温下,将5.4g铝片投入20mL18mol·L-1的硫酸中 |
| D.将足量的Cu置于50mL18mol·L-1H2SO4溶液中加热 |
用下列装置不能达到有关实验目的的是( )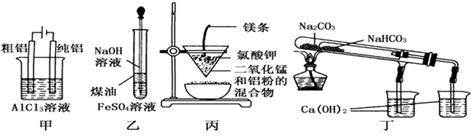
| A.用甲图装置电解精炼铝 |
| B.用乙图装置制备Fe(OH)2 |
| C.用丙图装置可制得金属锰 |
| D.用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
下列反应的离子方程式中正确的是
A.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| B.Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性: Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
将适量的SO2通入Fe(NO3)3中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
| A.S | B.Fe | C.Cl | D.N |