| A.氨气通入稀H2SO4溶液中: NH3+H+===NH 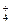 |
| B.CO2通入Na2CO3溶液中: CO2+CO 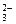 +H2O===2HCO +H2O===2HCO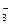 |
| C.Al2(SO4)3溶液跟偏铝酸钠溶液反应: Al3++3AlO 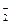 +6H2O===4Al(OH)3↓ +6H2O===4Al(OH)3↓ |
| D.Cl2通入冷的NaOH溶液中: |
2Cl2+2OH-===3Cl-+ClO-+H2O
下列图示与对应叙述相符合的是
| A.图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B.图Ⅱ:反应2SO2+O2═2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C.图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D.图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
在一定密闭容器中,反应aA(g)═bB(g)达平衡后,保持温度及各物质的量不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,则下列说法不正确的是
| A.平衡向正反应方向移动了 |
| B.物质A的转化率减少了 |
| C.容器体积增加可以是向其中充入了惰性气体 |
| D.a<b |
25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大 |
| D.将水加热,Kw增大,pH不变,呈中性 |
反应N2(g)+O2(g) 2NO(g)在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
2NO(g)在恒容密闭容器中进行,达到平衡后,充入N2,下列说法正确的是
| A.平衡向逆反应方向移动,N2和O2的转化率都减小 |
| B.平衡向正反应方向移动,N2和O2的转化率都增大 |
| C.压强增大平衡不移动,N2的转化率不变 |
| D.平衡向正反应方向移动,N2的转化率减小,O2的转化率增大 |
下列叙述中,不正确的是
| A.某特定反应的平衡常数仅是温度的函数 |
| B.催化剂不能改变平衡常数的大小 |
| C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D.化学平衡发生移动,平衡常数必发生变化 |