研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是
| A.铜与浓硫酸反应所得白色固体是CuSO4 |
| B.加BaCl2溶液后所得白色沉淀是BaSO3 |
| C.白色固体中夹杂的少量黑色物质可能是CuO |
| D.白色固体中夹杂的少量黑色物质中含元素Cu、S |
下列表达方式错误的是()
A. |
B.甲烷的电子式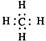 |
| C.硫离子的核外电子排布式 1s22s22p63s23p6 | D.碳-12原子构成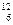 C C |
下列各组原子中,彼此化学性质一定相似的是()
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 |
| C.2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
某物质熔融状态可导电,固态可导电,将其投入水中水溶液也可导电,则可推测该物质可能是()
| A.金属 | B.非金属 | C.可溶性碱 | D.可溶性盐 |
萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F—周围最近距离的Ca2+数目为()
| A.2 | B.4 | C.6 | D.8 |
下列化合物中含有手性碳原子的是()
A.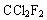 |
B.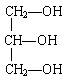 |
C.CH3CH2OH | D.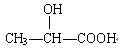 |