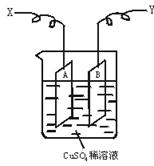
(1)当以I="0.21" A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________。(答“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品。A能发生如图所示的变化。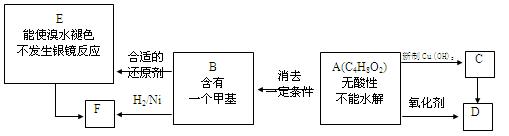
试回答:
(1)写出符合下述条件A的同分异构体的结构简式(各任写一种):
a.具有酸性,H-NMR谱图有3组峰________;
b.能发生水解反应,H-NMR谱图有4组峰_________。
(2)A分子中含氧官能团的名称是 ,D结构简式是 。
(3)写出化学方程式:A→B 。
(4)写出E生成高聚物的化学方程式: 。
(5)C的同分异构体C1与C有相同的官能团,两分子C1脱去两分子水形成含有六元环的C2,写出C1的结构简式(有几种写几种): 。
下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的
值一般高于理论值的主要原因是__________。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反
应时,元素④被还原到最低价,该反应的化学方程式为
__________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
各物质之间的转换关系如下图,部分生成物省略。
相关信息如下
i.X为红褐色沉淀; ii.A为单质,B为溶液,D和F为气体;
iii.反应②为某化工生产中的尾气处理方式,产物只有Y和H2O。
根据以上信息回答下列问题:
(1)组成A的元素在周期表中属于:(选填序号);
(A)主族元素(B)副族元素(C)过渡元素(D)短周期元素
(2)写出B物质的化学式:;
(3)写出反应②的化学反应方程式:;
(4)以石墨为两极材料,电解C的水溶液,写出电解初期阴极的电极反应式:;
(5)28g单质A与一定浓度的B溶液反应,当生成n(C):n(E):2:3时发生转移mol电子;
(6)在仅含E的溶液中加入Na2O2生成X时,写出当n(E):n(Na2O2)=1:1时反应的离子方程式:。
某有机化合物A的结构简式如图20,回答下列问题:
⑴ A的分子式为 ;
⑵ A在NaOH水溶液中加热得到B和C,C是芳香族化合物,则C的结构简式为 ;
⑶ B与足量的某饱和一元羧酸D充分反应后生成E ,E和B的相对分子质量之差为84 ,则D的摩尔质量为 ;
⑷ C酸化后可得F,F不能发生的反应类型是(填字母代号) ;
a.取代反应b.加成反应c.消去反应
d.加聚反应 e.氧化反应 f.还原反应
⑸ F可以发生如图21的转化,且G与H互为同分异构体。请写出:
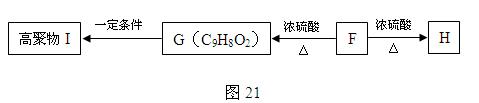
① H的结构简式 ;
② 由F生成G的化学方程式 ;
⑹ 符合下列三个条件的F的同分异构体共有 种。
① 含有邻二取代苯环结构 ② 与F具有相同的官能团
③ 不与FeCl3溶液发生显色反应
|
某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入浓盐酸,微热 |
黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② |
另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 |
有极少 量红色物质析出,仍有较多黑色固体未溶解 量红色物质析出,仍有较多黑色固体未溶解 |
由上述实验现象推断,黑色粉末X的成分是。
II、定量测定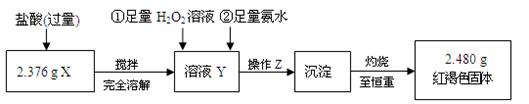
⑴ 操作Z的名称是,如图19的仪器中,在灼烧沉淀时必须用到的是(填字母)。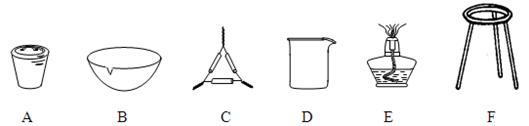
⑵ 写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
。
⑶ 将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1- b2= 0.3 g,则接下来还应进行的操作是
。
⑷ 有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示):
。
⑸ 通过以上数据,得出2.376 g黑色粉末中各成分的物质的量为。