2009年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
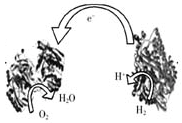
A.左边为该电池的正极 |
B.该电池可在高温环境下使用 |
C.该电池负极反应为:H2—2e-=2H+ |
D.该电池正极反应为O2+4e-=2O2- |
在体积可变的密闭容器中,反应mA(g)+nB(s) pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低,下列说法中,正确的是
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低,下列说法中,正确的是
| A.(m+n)必定小于p | B.(m+n)必定大于p |
| C.m必定小于p | D.m必定大于p |
NO2中存在下列平衡:2NO2 N2O4(g)(正反应是放热反应)。在测定NO2的相对分子质量时,下列条件中较为适宜的是
N2O4(g)(正反应是放热反应)。在测定NO2的相对分子质量时,下列条件中较为适宜的是
| A.温度130 ℃,压强3.03×105 Pa |
| B.温度25 ℃,压强1.01×105 Pa |
| C.温度130 ℃,压强5.05×104 Pa |
| D.温度0 ℃,压强5.05×104 Pa |
在一定温度下,可逆反应A(g) + 3B(g) 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A、C生成的速率和C分解的速率相等
B、A、B、C的浓度相等
C、单位时间内生成n摩A,同时生成3n摩B
D、A、B、C的分子数之比为1:3:2
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)2H2(g)+O2(g)===2H2O(l) ΔH3=-571.6 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为
| A.-488.3 kJ/mol | B.-244.15 kJ/mol | C.488.3 kJ/mol | D.244.15 kJ/mol |
下列说法中,正确的是
| A.ΔH>0 kJ/mol表示放热反应,ΔH<0 kJ/mol表示吸热反应 |
| B.1 mol H2SO4与1 mol Ba(OH)2反应时放出的热叫做中和热 |
| C.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数表示物质的量,所以可以是分数 |