在高温下,反应2HBr(g)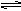 H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )
H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )
| A.减小压强 | B.缩小体积 |
| C.升高温度 | D.增大氢气的物质的量浓度 |
已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O (l)△H=-571.6KJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O (l) △H=-2220.0KJ/mol
实验测得氢气和丙烷共5mol,完全燃烧放热3847KJ/mol,则混合气体中氢气和丙烷的体积比为()
| A.3:1 | B.1:3 | C.1:4 | D.1:1 |
同温、同压下,下列各热化学方程式(△H均小于0)中反应热的绝对值最大的是()
| A.2A(l)+B(l)=2C(g) △H1 |
| B.2A(g)+B(g)=2C(g) △H2 |
| C.2A(g)+B(g)=2C(l) △H3 |
| D.2A(l)+B(l)=2C(l) △H4 |
燃烧bg液态乙醇生成CO2和液态水,放出的热量为aKJ。经测定bg乙醇与足量的钠反应能生成标准状况下的氢气5.6L,则乙醇燃烧的热化学方程式为 ()
| A.C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O (l)△H=-aKJ/mol |
| B.C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O (l)△H=-a/2KJ/mol |
| C.1/2C2H5OH(l)+3/2O2(g)=CO2(g)+ 3/2H2O (l)△H=-aKJ/mol |
| D.C2H5OH(l)+3O2(g)=2CO2(g)+ 3H2O (l)△H= +2aKJ/mol |
已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s) △H =-351.1KJ/mol
Hg(l)+1/2O2(g)=HgO(s) △H =-90.7KJ/mol
由此可知,Zn(s)+HgO(s)= ZnO(s)+Hg(l) 的△H 为 ()
| A.-441.8KJ/mol | B.-254.6KJ/mol |
| C.-438.9KJ/mol | D.-260.4KJ/mol |
在相同温度和压强下,将32g硫分别在纯氧中和空气中完全燃烧,令前者放出的热量为Q1,后者放出的热量为Q2,则关于Q1和Q2的相对大小正确的判断是()
| A.Q1= Q2 | B.Q1 > Q2 | C.Q1 <Q2 | D.无法判断 |