通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
⑴目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于 。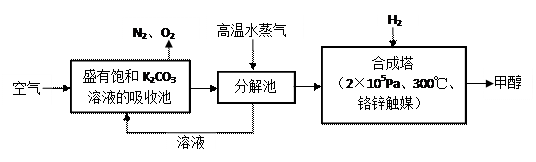 ⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为 。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶李明同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
李明应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
A、B、D、E、G 是原子序数依次增大的五种短周期元素。A 与E 同主族,A、B 和E的原子最外层电子数之和为19,B 与G 的单质都能与H2 反应生成“HX”(X 代表B 或G)型氢化物,D 为同周期主族元素中原子半径最大的元素。
(1) B 在元素周期表中的位置是_____________。
(2) D 的两种常见氧化物中均含有____________(填“离子键”或“共价键”)
(3) E 的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为_______。
(4) D 的最高价氧化物对应水化物的溶液与G 的单质反应,反应的离子方程式为_______。
(5) 共价键的极性随共用电子对偏移程度的增大而增强,A 和E 所形成氢化物中,共价键
极性的强弱顺序为____________>___________(用化学式表示)。
(6) 用原子结构解释“B、G 单质都能与H2 反应生成HX 型氢化物”的原因:_________。
铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 ① 周期,第② 族:PbO2的酸性比CO2的酸性 ③ (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 ④ 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ⑤ ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式
⑥ ,阴极观察到的现象是 ⑦ ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式 ⑧ ,这样做的主要缺点是 ⑨ 。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。a:T 100℃(填“大于”“小于”),判断理由是 。
b:列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
[化学——物质结构与性质]尿素 可用于制有机铁肥,主要代表有
可用于制有机铁肥,主要代表有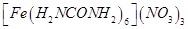 [三硝酸六尿素合铁(III)]。
[三硝酸六尿素合铁(III)]。
(1)基态Fe3+的核外电子排布式为__________。C、N、O三种元素的第一电离能由大到小的顺序是__________。
(2)尿素分子中C、N原子的杂化方式分别是___________。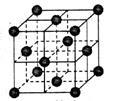
(3) 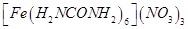 中“
中“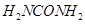 ”与Fe(III)之间的作用力是___________。与
”与Fe(III)之间的作用力是___________。与 互为等电子体的一种化合物是___________(写化学式)。
互为等电子体的一种化合物是___________(写化学式)。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有__________个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比是___________。