下列离子(或电极)方程式书写正确的是
| A.硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O = AgOH↓+ NH4+ |
| B.钢铁发生吸氧腐蚀的正极反应:4OH--4e- = 2H2O + O 2↑ |
| C.20mL0.1mol/LAlCl3溶液中加入70mL0.1 mol·L-1NaOH溶液:2Al3++7OH-= Al(OH)3↓+AlO2-+2H2O |
| D.向Ba(OH)2稀溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3•H2O+H2O |
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是()
| (I) |
(II) |
|
| A |
将少量浓氨水滴入Al2(SO)4溶液 |
将少量Al2(SO4)3溶液滴入浓氨水 |
| B |
将少量SO2通入Ba(OH)2溶液 |
将过量SO2通入少量Ba(OH)2溶液 |
| C |
将0.1mol Cl2通入含0.2 molFeBr2的溶液中 |
将0.3mol Cl2通入含0.2mol FeBr2溶液 |
| D |
将过量BaCl2溶液与少量Na2SO4溶液相混合 |
将少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
| a |
b |
c |
d |
|
| ① |
Si |
SiO2 |
H2SiO3 |
Na2SiO3 |
| ② |
Al |
AlCl3 |
NaAlO2 |
Al(OH)3 |
| ③ |
Cu |
CuO |
Cu(OH)2 |
CuSO4 |
| ④ |
Na |
NaOH |
Na2CO3 |
NaHCO3 |
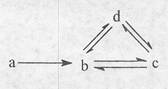
| A.①② | B.②③ | C.③④ | D.②④ |
下列实验能达到目的的是()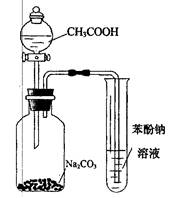
| A.分别加热蒸干灼烧NaAlO2溶液和AlCl3溶液,最终都能得到Al2O3 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
| C.检验Fe2O3中是杏含有FeO,用盐酸溶解样品后,滴加高锰酸钾溶液,观察溶液紫色是否褪色或变浅 |
| D.利用图示装置并根据有关实验现象能推知酸性: CH3COOH>H2CO3>C6H2OH |
用NA表示阿伏加德罗常数的数值,下列说法正确的是()
| A.lmol Na2O2晶体中共含有4NA个离子 |
| B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C.常温常压下16gO2和O3混合气体含有NA个氧原子 |
| D.电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
下列指定物质在_定条件下完全反应,转移2mol e-的是()
| A.1mol Cl2在点燃条件下与足量铁屑反应 |
| B.1mol NO2与水反应 |
| C.1mol H2O2分解 |
| D.1mol Cl2与NaOH溶液反应 |