在1 L的密闭容器中,充入1 mo1CO和1 mo1 H2O (g),于850℃时进行化学反应:CO(g) + H2O (g)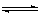 CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
| 时间/min |
n(CO)/ mo1 |
n(H2O)/mo1 |
n(CO2)/ mo1 |
n(H2)/ mo1 |
| 0 |
1 |
4 |
0 |
0 |
| 4 |
0.25 |
3.25 |
0.75 |
0.75 |
| 6 |
n1 |
n2 |
n3 |
n4 |
| 8 |
n1 |
n2 |
n3 |
n4 |
| t |
0.15 |
3.15 |
0.85 |
0.85 |
| A.前4 min,用CO表示的化学反应速率为v(CO)=0.25mol/(L·min) |
| B.反应在第4 min时处于化学平衡状态 |
| C.8分钟时,混合气体中CO2的体积分数为16% |
| D.t分钟时,反应所处的温度高于850℃ |
某气体水溶液呈酸性,该气体能使酸性高锰钾溶液褪色,也能使品红褪色,该气体是
| A.HBr | B.CO2 | C.SO2 | D.H2S |
保护环境是每一个公民的责任。下列做法:①推广使用无磷洗涤剂,②城市生活垃圾分类处理,③推广使用一次性木质筷子,④推广使用清洁能源,⑤过量使用化肥、农药,⑥推广使用无氟冰箱。其中有利于保护环境的是()
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |
地震过后,需及时采取有效的防疫措施。一些卫生专家建议使用15%的过氧乙酸(CH3COOOH,分子结构与H2O2一样都有“—O—O—”)溶液进行消毒。下列有关过氧乙酸的叙述正确的是()
| A.常温下,其水溶液有酸性 | B.本身是电解质 |
C. 不可能与醇发生酯化反应 不可能与醇发生酯化反应 |
D.可与苯酚混合使用 |
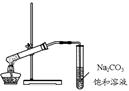
下列化学实验能达到目的的是()
| A.用激光笔检验某KI溶液中是否溶有淀粉 |
| B.加入氢氧化钠溶液后过滤,可除去苯中的少量苯酚 |
| C.向碘水中加入苯或酒精,均可从碘水中萃取碘 |
| D.用右图所示的装置制取少量的乙酸乙酯 |
已知C-C可以绕键轴旋转,对结构简式为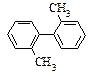 的烃,下列说法正确的是
的烃,下列说法正确的是
()
| A.该烃是苯的同系物 |
| B.该烃分子中的所有原子有可能处于同一平面内 |
| C.该烃的一氯代物最多有4种 |
| D.该烃分子中至少有9个碳原子处于同一平面上 |