甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,该燃料电池是以甲醇为燃料,氧气为氧化剂,电解质可以是质子交换膜(可传导氢离子),也可以是固体氧化物(可传导氧离子),甲醇和氧气分别在多孔金属电极上发生反应,从而将化学能直接转化为电能。下列叙述中错误的是
A.电池放电时,甲醇在负极发生氧化反应
B.以固体氧化物为电解质的电池放电时,氧离子由负极移向正极
C.以质子交换膜为电解质的电池放电时,正极的反应为:O2+4H++4e— 2H2O
D.电池的总反应是:2CH3OH+3O2 2CO2+4H2O
在一密闭容器中进行以下可逆反应:M(g)+P(g) N(g)+2 L。在不同的条件下P的百分含量P%的变化情况如图,则该反应
N(g)+2 L。在不同的条件下P的百分含量P%的变化情况如图,则该反应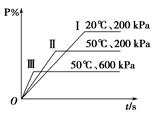
| A.正反应放热,L是固体 | B.正反应吸热,L是气体 |
| C.正反应吸热,L是固态 | D.正反应放热,L是固体或气体 |
在密闭容器中进行反应X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.1 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Y2为0.1 mol·L-1 | B.X2为0.1 mol·L-1 |
| C.Y2为0.35 mol·L-1 | D.Z为0.3 mol·L-1 |
将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是
| A.醋酸的浓度达到1 mol·L-1 |
| B.H+的浓度达到0.5 mol·L-1 |
| C.醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol·L-1 |
| D.醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等 |
下列说法可以证明反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
| A.1个N≡N键断裂的同时,有3个H—H键形成 |
| B.1个N≡N键断裂的同时,有3个H—H键断裂 |
| C.N2、H2、NH3的分子数之比为1∶3∶2 |
| D.1个N≡N键断裂的同时,有6个H—N键形成 |
中和热是在稀溶液中,强酸、强碱发生中和反应生成1 mol水时放出的热量,中和热为57.3 kJ/mol。下列热化学方程式中正确的是
| A.HNO3(aq)+KOH(aq)===H2O(l)+KNO3(aq) ΔH>-57.3 kJ/mol |
| B.HNO3(aq)+NH3·H2O(aq)===H2O(l)+NH4NO3(aq)ΔH<-57.3 kJ/mol |
| C.CH3COOH(aq)+KOH(aq)===H2O(l)+CH3COOK(aq) ΔH<-57.3 kJ/mol |
| D.CH3COOH(aq)+NH3·H2O(aq)===H2O(l)+CH3COONH4(aq) ΔH>-57.3 kJ/mol |