在20℃ 时,某气态烃与氧气混合装入密闭容器中,点燃爆炸后,又恢复到20℃ 。此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎真空。此烃的化学式可能是( )
| A.CH4 | B.C3H4 | C.C2H4 | D.C3H8 |
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)  xC(g),符合下图甲所示的关系(c%表示平衡混合气体中产物C的百分含量,T表示温度,p表示压强)。则图乙中y轴是指
xC(g),符合下图甲所示的关系(c%表示平衡混合气体中产物C的百分含量,T表示温度,p表示压强)。则图乙中y轴是指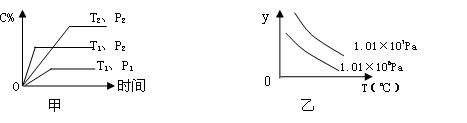
A.C的转化率 B.平衡混合气中B的百分含量
C.平衡混合气的平均相对分子质量D.平衡混合气的密度
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 
| A.t2时加入了催化剂 |
| B.t3时降低了温度 |
| C.t5时增大了压强 |
| D.t4~t5时间内反应物的转化率一定最低 |
在一个密闭容器中,可逆反应aA(g) bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则:
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则:
| A.平衡向正反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数减小了 | D.a>b |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应;3A(g)+2B(g) 4C(s)+2D(g)
4C(s)+2D(g) ,反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
,反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
| A.该反应的化学平衡常数表达式是K="" |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动。B的平衡转化率增大 |
密闭容器中进行如下反应:2 SO2(g) + O2(g) 2SO3(g), 已知SO2、O2、SO3的起始浓度分别为 0.6mol/L, 0.2 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
2SO3(g), 已知SO2、O2、SO3的起始浓度分别为 0.6mol/L, 0.2 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是:
| A.SO20.2mol/L | B.C(SO2)+C(SO3)=0.8mol/L | C.O20.3mol/L | D.SO3 0.6mol/L |