某铁的“氧化物”样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是 ( )
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
在溶液中加入足量的Na2O2后仍能大量共存的离子组是
| A.NH4+、Ba2+、Cl—、NO3— | B.K+、AlO2—、Cl—、SO42— |
| C.Ca2+、Mg2+、NO3—、HCO3— | D.Na+、Cl—、CO32—、SO32— |
已知: , ,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
| A. |
|
B. |
|
| C. |
|
D. |
|
下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是
| A. | 3和17 | B. | 1和8 | C. | 1和6 | D. | 7和12 |
为实现“绿色奥运”,下列环保建议中你认为可以采纳的是
①用天然气代替汽油和柴油作为发动机燃料
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发利用无磷洗涤剂
| A.①③④ | B.②③④⑤ | C.①②④⑤ | D.全部 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
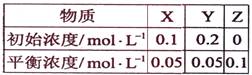
 下列说法错误的是:()
下列说法错误的是:()



| A. | 反应达到平衡时,X的转化率为50%  |
B. | 反应可表示为X+3Y  2Z,其平衡常数为1600 2Z,其平衡常数为1600  |
C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大  |
D. | 改变温度可以改变此反应的平衡常数 |