某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如下图。
②强度为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。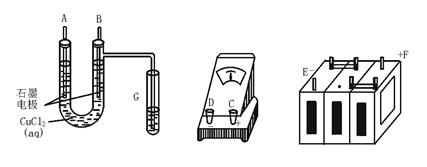
试回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同)
E接____________,C接____________,____________接F。
实验线路中的电流方向为________→_______→________→C→________→________
(2)写出B电极上发生反应的离子方程式____________,G试管中淀粉KI溶液变化的现象为____________,相应的离子方程式是____________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是____________。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19 C。试列出阿伏加德罗常数的计算表达式:NA=____________。
硫化钠是一种重要的化工原料。工业上用硫酸钠与碳反应得到硫化钠。反应方程式如下:
Na2SO4 + 2C Na2S + CO2↑
Na2S + CO2↑
完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子有 种能级不同的电子。
(2)下列可以证明二氧化碳是非极性分子的事实是 (填编号)
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)硫化钠在一定条件下会与硫单质反应生成多硫化钠(Na2SX)。在碱性溶液中,Na2SX与NaBrO3反应生成Na2SO4与NaBr。若Na2SX与NaBrO3反应的物质的量之比为3:16,则 x = 。
(4)写出硫氢化钠与少量硫酸铜溶液反应的离子方程式 。能否用硫酸铜溶液来鉴别硫化钠溶液和硫氢化钠溶液?请简述实验操作和现象并说明自己的观点: 。
(5)已知:H2S Ki1 = 9.1×10-8 Ki2 = 1.1×10-12 HF Ki = 3.5×10-4
H2SO3 Ki1 = 1.5×10-2 Ki2 = 1.0×10-7 HAc Ki = 1.75×10-5
若用右图的装置,用硫化钠固体和下列溶液制取硫化氢气体,可选用的试剂是 。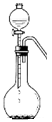
a.硝酸 b.亚硫酸氢钠 c.氢氟酸 d.醋酸
综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如下图所示:
(1)反应①~⑤中,属于氧化还原反应的是 。
(2)写出反应②的离子方程式 。
(3)X溶液中的主要阳离子是Na+和 。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;
③ ;④加适量盐酸;⑤ (请补全缺少的实验步骤)。
(5)检验纯碱样品中是否含NaCl应选用的试剂是 。
海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:
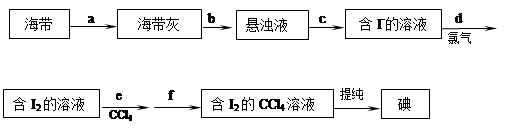
试回答:
(1)步骤a的操作名称是 ,步骤b中所加的物质是 。
(2)步骤c的操作名称是 ;该操作中涉及到的玻璃仪器有漏斗、烧杯和 。
(3)步骤d中发生反应的离子方程式为 。
(4)步骤e的操作名称是 ,操作时在含I2的溶液中加入CCl4,振荡、静置后,液体分为两层,下层液体呈 色。
(5)步骤f的操作名称是分液,所用的主要仪器是 。
有一固体粉末可能由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的一种或几种组成,对该粉末做实验时有以下结果:(1)固体加入水中有白色沉淀,上层清液为无色;(2)所得白色沉淀加入稀硝酸后部分溶解。
由此可知:该粉末中一定有 ;一定没有 ;
不能确定的是 。如要检验其是否存在,将如何操作 。
写出题目中有关反应的离子方程式: 。
高锰酸钾和氢溴酸溶液可以发生下列反应:
2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O,其中氧化剂是_________,若消耗15.8g氧化剂,则被氧化的还原剂的质量是 ,转移电子_________mol。
请用双线桥表示该反应电子转移的方向和数目: 。