已知在催化剂作用下,苯和卤代烃反应可以在苯环上引入烷烃基,生成苯的同系物。如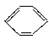 +CH3CH2Cl
+CH3CH2Cl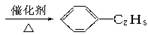 C2H5+HCl,现从苯出发制取十二烷基苯,再进一步制取合成洗涤剂十二烷基苯磺酸钠,分子式为
C2H5+HCl,现从苯出发制取十二烷基苯,再进一步制取合成洗涤剂十二烷基苯磺酸钠,分子式为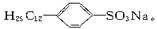
提供的原料除苯外,还有水、浓硫酸、十二烷、食盐及催化剂等,试用化学方程式表示此制取过程。(已知电解食盐水生成Cl2、H2和NaOH)
(1)______________________________(2)_______________________________;
(3)______________________________(4)______________________________;
(5)______________________________。
甘油的用途很广,大量用来制造硝化甘油,硝化甘油是甘油与浓硝酸发生酯化反应(在浓硫酸条件下)生成的三硝酸甘油酯.硝化甘油是制备炸药的原料,在医疗上又是心脏病的急救药.试写出以油脂(主要成分是硬脂酸甘油酯)、氨气、空气、水和氢氧化钠为原料制取硝化甘油的化学方程式.
_______________,_______________,_______________,_______________,_______________.
柴杉醇是一种新型抗癌药,其分子式C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
B.R—OH(R是一个含C、H、O的基团)
(1)A可在无机酸的催化下水解,其反应方程式是:____________________________。
⑵ A水解所得的氨基酸不是天然蛋白质的水解产物,因为。
(3)写出R-OH的分子式_____________________________。
27.某学生进行蔗糖水解实验,并检验水解产物中是否含有葡萄糖。该生拟定如下操作:
| A.取一只试管制取Cu(OH)2沉淀备用; | B.再加入3ml~5mlH2SO4; | C.再加入3ml~5mlNaOH溶液; | D.加入NaOH溶液中和其中的硫酸;E.加入稀硫酸中和其中的氢氧化钠;F.把氢氧化铜沉淀加入溶液中;G.加热煮沸几分钟;H.加热至沸,观察之;I.取一支试管加入少量蔗糖溶液。 |
⑴从上述操作中选择必要的若干步,按实验正确顺序填入下列空格中:
A—()—()—()—( )—( )—( )
⑵写出蔗糖水解的化学方程式 。
⑶写出用氢氧化铜检验葡萄糖的化学方程式 。
下列有机实验操作或叙述中正确的是(填写代号)。
| A.用银氨溶液检验某病人是否患糖尿病 |
| B.乙酸乙酯中的少量乙酸可用饱和碳酸钠溶液除去 |
| C.蔗糖水解时应用浓硫酸作催化剂 |
| D.在鸡蛋白溶液中滴入浓硝酸,微热会产生黄色物质 |
E.在植物油中滴入溴水,溴水会褪色
F.用盐析法分离油脂皂化反应的产物
G.在酒精中加新制生石灰后蒸馏制无水酒精
H.制酚醛树脂时,应将温度计插入水浴中
.在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的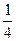 ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为________________