某烯烃1 mol与H2加成后产物为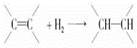 ,则原烯烃可能的结构简式为________________________。
,则原烯烃可能的结构简式为________________________。
W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图____________;M元素在元素周期表中的位置为______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质______________();
X与W按原子个数比2:1形成的化合物_____________()。
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为__________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性_______________________(用氢化物分子式表示);Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式:
________________________,________________________,______________;
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为 ,B为 。
(2)写出元素C在周期表中的位置 。
(3)D的最高价氧化物的水化物化学式是。
(4)E属(“离子”或“共价”)化合物。E中含键。
(5)写出A、B形成的化合物与E反应的化学方程式:
。
(6)C与D两元素可形成化合物,用电子式表示其化合物的形成过程
。
(1)下列微粒之间,属于同位素的是,属于同素异形体的是,
属于同分异构体的是,属于同一种物质的是:。(填字母)
| A.正丁烷和异丁烷 | B.红磷和白磷 | C.氕和氚 | D.氯气和液氯E.冰和干冰 |
H.CH3CH2CH2OH和CH3OCH2CH3F.氧气和臭氧G.13C和14C
(2)有下列几种物质:①氯化铵 ②金刚石 ③硫 ④铁 ⑤氯化钠 ⑥钠 ⑦二氧化硅 ⑧干冰,其中:a.硬度最大的物质是(填编号,下同)。b.以共价键相结合,原子彼此间形成空间网状结构的化合物是;晶体内存在单个分子的单质是。 c.晶体中既有离子键又有共价键的是。
1.92gCu片与定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用。则
(1)反应中消耗HNO3_______mol(2)被还原的HNO3________mol
(3)转移电子________mol
在m mL b mol·L-1 AlCl3溶液中,加入等体积a mol·L-1的NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是___________mol。
(2)当a、b满足_____________条件时,无沉淀生成。
(3)当a、b分别满足___________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________ mol