碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗涤、烘干、称量。洗涤沉淀的操作是 ______________________________ 。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应后,用下图装置测定产生CO2气体的体积,为了测量结果准确,B中的溶液最好采用___________________,但选用该溶液后实验结果仍然不够准确,其原因是_______________________。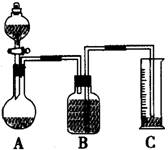
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管质量,利用其质量差求算样品的纯度。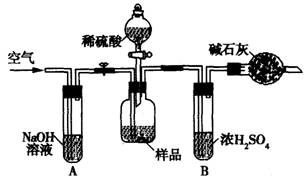
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为mg ②取ng样品装入广口瓶中
③检验装置的气密性 ④缓慢鼓人空气数分钟,再称量干燥管质量为Mg ⑤关闭止水夹
⑥打开止水夹 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧缓慢鼓人空气数分钟
Ⅰ.正确的操作顺序是(填写序号):③→_________→⑥→______⑤→________⑦→______
Ⅱ.在操作④中,要缓慢鼓人空气数分钟,鼓人空气的作用是_________ ;装置A的作用是 _________;装置B的作用是 _____________。
Ⅲ.若去掉装置A,测定结果______________ ;若去掉装置B,测定结果_________ (填“偏大”、“偏小”或“无影响”)。
在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有SiO32-?(填“有”或“没有”),判断理由是。(用离子方程式表示)
(2)生成的气体中一定有。它具有的性质是(填字母序号)。
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
E、能被NaOH溶液吸收
(3)原溶液中可能含有的阴离子是。
(4)溶液中减少的离子是,原因是(用离子方程式表示)。
现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
又知甲、乙、丙分子均含有10个质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是(填写选项的编号,下同)(①A②B③C④D)
写出转化关系图中已确认的反应的化学方程式:
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是。
A.化合物甲与丙、乙与丙均能够发生反应
B.化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
C.通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
D.单质C和化合物丁不能共存。
依据该条件推断,第四种元素在周期表中的位置为。
(3)按(2)中的另外三个补充条件推断第四种元素。丙的空间构型为___________。
硫醇-烯具有反应过程相对简单、反应过程可控等优点,成为近年来有机合成的研究热点之一,如反应①: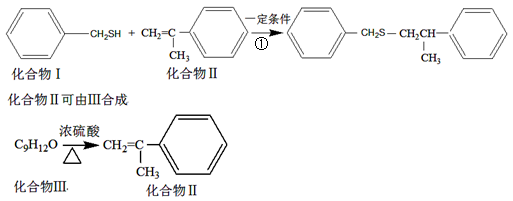
(1)化合物I的分子式为______________,反应①的反应类型为______________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为______________。
(3)化合物Ⅲ的氧化产物化合物Ⅳ能发生银镜反应,则Ⅲ的结构简式为_________。
化合物Ⅳ与新制Cu(OH)2反应的化学方程式____________________________。
(4)化合物Ⅲ的一种同分异构体Ⅴ有如下特征:a.含有苯环,且苯环上有两个取代基;b.能与FeCl3溶液发生显色反应;c.核磁共振氢谱显示存在5组峰,峰面积之比为1:1:2:2:6。化合物Ⅴ的结构简式为____________。
Ⅰ.“中东有石油,中国有稀土”。稀土金属是我国战略性资源,应加以保护。稀土金属是周期表中ⅢB族中钪、钇和镧系十七种元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价。钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe3+ |
2.7 |
3.7 |
| Y3+ |
6.0 |
8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则最好选用盐酸和(填字母)
两种试剂,通过必要的操作即可实现。
A.NaOH溶液 B、氨水 C、CO2 D、HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为,继续加氨水调至pH=b,此时发生反应的离子方程式为。
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式:。
Ⅱ镧系元素铈(Ce)是地壳中含量最高的稀土元素,在加热的条件下CeCl3易发生水解。
(4)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是___
。
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过反应形成Ce(OH)4沉淀得以分离,写出反应的离子方程式。
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g)△H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g)△H=-41.2kJ/mol ,制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1) 已知:850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图1所示: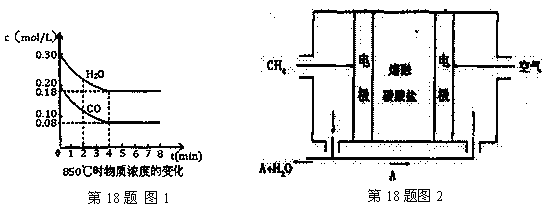
下列说法正确的是(填序号)
| A.达到平衡时,氢气的物质的量是0.12mol |
| B.达到平衡时,反应体系最终会放出49.44kJ热量 |
| C.在0—4min,混合气体的平均相对分子质量增大 |
| D.第6min时,若升高温度,反应平衡常数会减小 |
E.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(2) 850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
(3) 如将H2与CO2以4:1的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g)+2O2(g)=CO2(g)+ 2H2O(l) ΔH1=-890.3 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是。
(4) 熔融盐燃料电池(见图2)是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。正极的电极反应是________。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。实验过程中,若通入了标准状况下空气448 L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4____________L。