有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定量的这些烃,完全燃烧后生成mmol CO2和nmolH2O。则
(1)当m=n时,该烃是 ;
(2)当m=2n时,该烃是 ;
写出下列微粒的电子式:
(1)有14个电子的双原子分子______。
(2)有14个电子具漂白性的含氧酸分子____。
(3)铵离子______。
在如右图所示的实验装置中,E为一张淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹,X、Y分别为直流电源的两极。 在A、B中充满KOH溶液后倒立于盛有KOH
溶液的水槽中,再分别插入铂电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,请回答下列问题: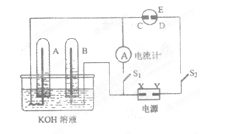
(1)标出电源的正、负极:X为极,Y为极。
(2)在滤纸的C端附近,观察到的现象是,在滤纸的D端附近,观察到的现象是。
(3)写出电极反应式:A中;B中;C中;D中。
(4)若电解一段时间后,A、B中均有气体包围电极,此时切断开关S2,闭合开关S1,则电流计的指针是否发生偏转(填“偏转”或“不偏转”)。
(5)若电流计指针偏转,写出有关的电极反应式(若指针不偏转,此题不必回答):A中;B中。若电流计指针不偏转,请说明理由(若指针不偏转,此题不必回答)
X,Y,Z,M为金属活动顺序表中常见的四种金属元素,在常温下都不和冷水反应。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有气体放出;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知在X和M的阳离子溶液中,加入过量的氢氧化钾溶液,M生成相应的氢氧化物的沉淀,试写出四种金属的活泼性由强到弱的顺序______。
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、________。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________(填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________(填写离子符号)转化为沉淀。经过滤后的废水主要含________,可用来浇灌农田。
二氧化碳的过量排放,严重影响人类的自下而上环境,处理和利用二氧化碳是全球关注的重大问题。回答以下问题。
(1)大气中二氧化碳增加的原因有_______________、________________等。
(2)钟乳石和石笋的主要成分是碳酸钙。随着旅游人数的增加,潮湿溶洞中的钟乳石和石笋受到二氧化碳侵蚀,其化学方程式为:______________________________________。
(3)某学生提出一个修复溶洞底部受损石笋的研究方案,由以下五步组成,正确的实验步骤依次是______________。
①将盛有碱溶液的容器置于石笋的上部; ②配制一定浓度的碱溶液; ③选择合适的碱;④调节碱溶液下滴的速度; ⑤观察石笋表面复原情况
(4)合理利用二氧化碳,可以提请生活质量,促进工业发展。在采煤工业上,把干冰与炸药放在一起,既能增强爆炸威力,又能防止火灾。能增强爆炸威力的原因是_________________________;能防止火灾的原因是_________________________。