据中国纺织流通协会数据统计,2006年8月份全国生产维纶纤维3424吨,与去年同比增长10.59%。维纶的成分是聚乙烯醇缩甲醛,它可以由石油的产品乙烯为起始原料进行合成,其主要步骤是由乙烯、氧气和醋酸合成酯酸乙烯酯,化学方程式如下:
CH2==CH2 + O2 + CH3COOH CH3COOCH==CH2+ H2O
然后再经过加聚、水解、缩合制得维纶。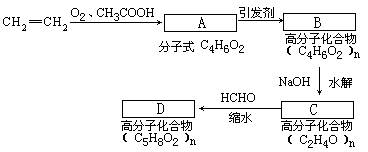
(1) A→B的反应类型为________________。
(2)请确定A、B、D的结构简式:
A:________________B:________________ D:_______________。
(3) 写出C的单体的的同分异构体的结构简式:________________。
下表为元素周期表短周期的一部分
| A |
B |
D |
||
| H |
(1)H最高价氧化物对应水化物的钠盐溶液中通入少量A的最高价氧化物会发生反应,写出相应的离子方程式;
(2)写出工业上制备H单质的化学方程式;
(3)X、Y为同周期元素,它们简单离子的电子层结构与D离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式。
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的。工业上制取Y和W的无水化合物方法如下:Y的氧化物与A、W的单质在高温条件下反应,每消耗6 kg A的单质,过程中转移
1×103 mol电子,写出相应反应的化学方程式。
(5)X与B形成的化合物XB3是合成抗禽流感药物“达菲”的中间活性物质,该物质受撞击会生成一种非金属单质和一种离子化合物X3B,请写出该反应的化学方程式
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。 已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O
已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
请回答:
(1)K2Cr2O7中Cr元素的化合价是。
(2)生成滤渣1中红褐色物质的反应的化学方程是。
滤液1的成分除Na2CrO4外,还含有(填化学式)。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是。
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl-CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
_______________________________________________________________
(4)甲同学最终确定原溶液中所含阳离子是,阴离子是。(写离子符号)
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是__________________。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
| D |
碱性的废水 |
用CO2来中和 |
化学法 |
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1) 在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g) △H= +131kJ/mol
C(s)+O2(g)=CO2(g) △H= —394kJ/mol
CO(g)+ O2(g)=CO2(g) △H= —283kJ/mol
O2(g)=CO2(g) △H= —283kJ/mol
则CO(g)+H2O(g) H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=
(2)已知830℃时,在一个容积固定的密闭容器中,发生反应
CO(g)+H2O(g) H2(g)+CO2(g)下列能判断该反应达到化学平衡状态的是(填字母)。
H2(g)+CO2(g)下列能判断该反应达到化学平衡状态的是(填字母)。
a.容器中的压强不变b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.  (CO)=
(CO)= (H2O)d.c(CO)=c(H2)
(H2O)d.c(CO)=c(H2)
又知此温度下该反应的平衡常数K=1,等物质的量的CO和H2O反应达到平衡时,CO的转化率为.
(3) 将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
①实验l中以 (CO2)表示的反应速率为。
(CO2)表示的反应速率为。
②该反应的逆反应为(填“吸”或“放’’)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是(用含a、b的数学式表示)。
(4)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
3H2(g)+CO2(g) CH3OH(g)+H2O(g),右图表示
CH3OH(g)+H2O(g),右图表示
该反应进行过程中能量(单位为kJ·mol)的变化。
①在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使c(CH3OH)增大的是(填字母)
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入l mol CO2和3 molH2
②当反应达到平衡时不断改变条件(但不改变
各组分物质的量和状态且只改变一个条件)反应速率随时间的变化如右图:其中表示平衡混合物中CH3OH含量最高的一段时间是;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1K2(填“大于”、“等于”或“小于”)。
(5)煤气化过程中会生成少量CH4,已知CH4与CaSO4反应生成CaS、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为。
(8分)(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是________________________________________________________________________
________________________________________________________________________________________________________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)__________________________________ ______________________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:________ ________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是________。
| A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应 |
| B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应 |
| C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应 |
| D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应 |