根据以下反应①Fe+CuCl2══Cu+FeCl2 ②2FeCl3+Cu══2FeCl2+CuCl2,判断:Fe3+、Fe2+、Cu2+氧化性强弱的顺序是( )
| A.Fe3+>Fe2+>Cu2+ | B.Fe2+>Cu2+>Fe3+ |
| C.Cu2+>Fe2+>Fe3+ | D.Fe3+>Cu2+>Fe2+ |
将氢氧化钠 稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是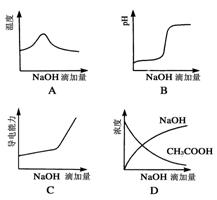
水的电离过程为H2O H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随温度的升高而降低 | B.35℃时,c(H+)>c(OH-) |
| C.溶液:pH(35℃)>pH(25℃) | D.水的电离是吸热的过程 |
恒温恒压下,在容积可变的器皿中,反应2NO2(气) N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A 不变 B 增大 C 减小D 无法判断
B 增大 C 减小D 无法判断
在一定体积的密闭容器中放入3升气体R 和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气)
和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气) 4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A 2 B 3 C 4 D 5
将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸 性 性 |
B.水的离子积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 | D.水的离子积变大、pH变小、呈中性 |