下列离子方程式正确的是( )
A.碳酸钙和盐酸反应: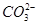 +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
B.向氢氧化钡溶液中加硫酸溶液:Ba2++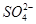 =BaSO4↓ =BaSO4↓ |
| C.向氯化铜溶液中加铁粉:Cu2++Fe=Cu+Fe2+ |
| D.向稀盐酸溶液中加铁:2Fe+6H+=2Fe3++3H2↑ |
下列有机物用于合成聚乙烯塑料,是聚乙烯的单体的是
| A.CH4 | B.CH2=CH2 | C.CH3CH2OH | D.CH2=CHCH3 |
黄铜(Zn-Cu合金)的质地、手感、颜色与黄金十分相似,曾经有很多不法商贩利用黄铜冒充黄金欺骗路人。下列方法中,不能区分黄铜与黄金的是
| A.看外观 | B.用盐酸 | C.测定密度 | D.用火烧 |
白蚁能分泌一种叫做蚁酸的物质,其化学性质与乙酸相似。据此判断,下列物质最不容易被蚁酸腐蚀的是
| A.黄金饰品 | B.镀锌水管 | C.石灰墙面 | D.铝合金门窗 |
下列作用不属于水解反应的是( )
| A.吃馒头时多咀嚼后有甜味 |
| B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色 |
| C.葡萄糖被氧化成二氧化碳与水 |
| D.油脂与氢氧化钠溶液共煮后制肥皂 |
下列药物类型中由于过度使用导致人类面临无药可用的危机的是()
| A.中成药 | B.抗生素 | C.维生素等保健药 | D.抗酸药 |