关于牺牲阳极阴极保护法的叙述中正确的是()
| A.正极是阳极 | B.负极是阴极 |
| C.阳极上发生氧化反应 | D.正极上发生氧化反应 |
下列描述不正确的是()
| A.纯锌与稀硫酸反应比粗锌的反应速率快 |
| B.用稀硫酸与锌制取氢气时,加入少量硫酸铜溶液,可加快反应的速率 |
| C.纯铁比生铁更难发生电化学腐蚀 |
| D.钢铁腐蚀主要是吸氧腐蚀 |
钢铁在空气中发生电化学腐蚀时,正极上发生的电极反应为()
A.Fe —3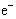 ="=" ="=" 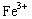 |
B.2H2O + O2 + 4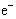 ==4OH- ==4OH- |
C.Fe —2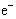 ="=" ="=" 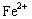 |
D.4OH-—4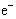 ==2H2O + O2↑ ==2H2O + O2↑ |
表明金属甲比金属乙活动性强的是()
| A.在氧化还原反应中,甲失电子比乙的多 |
| B.同价态的阳离子,甲比乙氧化性强 |
| C.甲能与盐酸反应放出氢气而乙不能 |
| D.将甲乙组成原电池时,甲为正极 |
下列措施不能起到防腐作用的是()
| A.对钢铁设备喷油漆 | B.对钢铁进行电镀 |
| C.把钢铁与镍、铬等金属制成合金 | D.把钢铁放入水下 |