Al(OH)3的电离方程式可表示为:H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) ________。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= ________mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_________。
2013年4月26日,人民网报道,浙江温岭一河流氨氮超标五倍,河水黑臭如墨水。氮氧化物污染日益严重,请分析下列有关NO、NO2等的试题,然后填空。
(1)下图所示为N2(g)和O2(g)生成NO(g)过程中的能量变化。
由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式。
(2)下图是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:。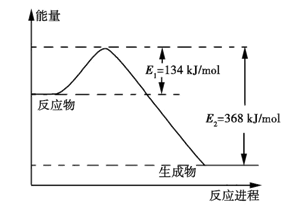
(3)已知:在298 K、101 kPa下,由稳定的单质生成1 mol化合物的反应热叫做该化合物的生成热。如图为氧族元素(除钋外)的氢化物a、b、c、d的生成热数据示意图。
①你归纳:非金属元素的气态氢化物的稳定性与氢化物的生成热(ΔH)之间的关系。
②写出硒化氢在298 K、101 kPa时发生分解反应的热化学反应方程式。
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色氯化亚铜溶液中,溶液变为棕黄色,写出该反应的离子方程式______________。
(3)写出B的基态原子电子排布图为。与PH3相比,BA3易液化的主要原因是_____________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子。
(1)在研究的化合物分子中,所处环境完全相同的氢原子在质子核磁共振谱(PMR)中出现同一种信号峰,如(CH3)2CHCH2CH3在PMR谱中有四种信号峰。化学式为C2H6O的物质在PMR谱上观察到下列两种情况下:化合物A出现一个信号峰,化合物B出现三个信号峰,由此可推断有机物质结构式为:A 、B 。
(2)①生活中PVC管材的成分为聚氯乙烯。氯乙烯可以由乙炔和氯化氢反应制得,其化学方程式为;
②聚乙炔是制备有机导体材料的重要原料,请写出制得聚乙炔的化学方程式。
(3)C7H8是苯的同系物,
①它的一氯代物有种;
②它被酸性高锰酸钾溶液氧化后,有机产物的结构简式为;
③它可以与足量的浓硫酸和浓硝酸的混酸反应制备烈性炸药TNT,反应方程式为。
根据下面的反应路线及所给信息填空: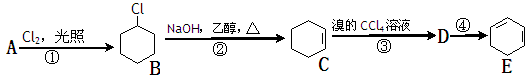
(1)A的结构简式是,名称是;
(2)填写以下反应的反应类型:①;②;③;
(3)反应④的反应试剂及反应条件;
(4)反应②的化学方程式为;
B水解的化学方程式为。