20℃时,H2S的饱和溶液1L,浓度约0.1 mol·L-1,其电离方程式第一步为:H2S H++HS-;第二步:HS-
H++HS-;第二步:HS- H++S2-,若使溶液H+、S2-浓度同时减小,可采取的措施是( )
H++S2-,若使溶液H+、S2-浓度同时减小,可采取的措施是( )
| A.加入适量NaOH固体 | B.加入适量水 |
| C.通入适量SO2 | D.加入适量CuSO4固体 |
对已达化学平衡的下列反应 2X(g)+ Y(g) 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
1molX 气体跟 amolY 气体在体积可变的密闭容器中发生如下反应:X(g)+ aY(g)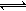 bZ(g)反应达到平衡后,测得 X 的转化率为 50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则 a和 b的数值可能是
bZ(g)反应达到平衡后,测得 X 的转化率为 50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则 a和 b的数值可能是
| A.a= 3,b= 1 | B.a= 2,b= 1 | C.a= 2,b= 2 | D.a= 3,b= 2 |
在一固定容积的密闭容器中进行如下反应:N2+3H2 2NH3△H < O在一定温度下反应达到平衡状态,若将平衡体系中各物质的浓度都增加到原来的2倍,下列叙述正确的是
2NH3△H < O在一定温度下反应达到平衡状态,若将平衡体系中各物质的浓度都增加到原来的2倍,下列叙述正确的是
| A.化学平衡不发生移动 | B.化学平衡向正反应方向移动 |
| C.化学平衡向逆反应方向移动 | D.正反应速率增大,逆反应速率减小 |
下图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指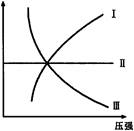
①N2(g)+3H2(g)  2NH3(g);△H=-Q
2NH3(g);△H=-Q
②H2(g)+I2(g)  2HI(g); △H=+Q
2HI(g); △H=+Q
③CO(g)+2H2(g) CH3OH(g); △H=-Q
CH3OH(g); △H=-Q
④2SO3(g)2 2SO2(g)+O2(g); △H=+Q
2SO2(g)+O2(g); △H=+Q
| A.平衡混合气中一种反应物的物质的量 | B.平衡混合气中一种反应物的百分含量 |
| C.平衡混合气中一种生成物的转化率 | D.平衡混合气中一种反应物的转化率 |
对于反应A(g)+2B(g)  2C(g) △H < O,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g) △H < O,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是