常温下,将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
(1)溶液中共有______________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是______________和______________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=______________mol。
草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取wg草酸晶体,配成100.00 mL溶液。
(2)取25.00mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol/LKMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①滴定时,KMnO4溶液应盛在__________(填酸式或碱式)滴定管中;
②若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低或无影响);
③滴定终点时,锥形瓶内溶液颜色变化是_____________________;
④若滴定终点时,共用去KMnO4溶液V mL,求x的值为________________。
在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g)  CO2(g)+H2(g)△H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g)△H<0,CO和H2O浓度变化如图,则
(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 c.增大了CO2浓度 d.增加了氢气浓度
用离子方程式解释下列过程:
(1)纯碱溶液显碱性:____________________。
(2)泡沫灭火器的反应原理(硫酸铝溶液与小苏打):_______________________。
(3) AgCl的浊液中加入KI溶液,白色沉淀变为黄色:____________________。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极。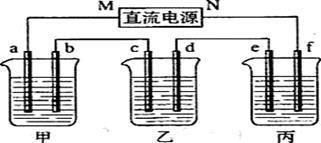
(1)接通电源,经过一段时间后,测得e电极上收集到气体在标准状况下体积为4.48L,乙中c电极质量增加。据此回答问题:
①电源的N端为 极。
②电极b上发生的电极反应为
③电解前后甲溶液 pH ;乙溶液 pH ;丙溶液 pH 。(填“变大”、“ 变小”或“不变”)
(2)写出乙溶液中的电解反应方程式: 需加入 g (填物质名称)复原。
常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)一c(A-)= mol/L,c(OH-)一c(HA)= mol/L。
③已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”);